题目内容
1.有关电解质溶液下列说法正确的是( )| A. | 常温下同浓度的强酸、强碱等体积混合后由水电离出的c(H+)=10-7mol•L-1 | |
| B. | 将AlCl3溶液、Na2SO3溶液蒸干并灼烧可以得到Al2O3、Na2SO3 | |
| C. | 常温下0.1mol•L-1的Na2A溶液的pH=10,则该溶液中由水电离的c(OH-)=10-10mol•L-1 | |
| D. | 常温下pH=2的盐酸和pH=12的氨水等体积混合后c(Cl-)+c(H+)<c(NH4+)+c(OH-) |
分析 A.强酸与强碱的物质的量相等,但是氢离子与氢氧根离子的物质的量不一定相等;
B.亚硫酸钠在加热过程中易被氧化成硫酸钠;
C.Na2A溶液中A2-离子水解促进了水的电离,该溶液中氢氧根离子是水的电离的;
D.氨水为弱碱,混合液中氨水过量,溶液呈碱性,则c(H+)<c(OH-),结合电荷守恒判断.
解答 解:A.常温下同浓度的强酸、强碱等体积混合后,由于没有告诉酸中含有氢离子、碱中含有氢氧根离子数目,则混合液不一定呈中性,由水电离出的c(H+)不一定为10-7mol•L-1,故A错误;
B.将AlCl3溶液蒸干并灼烧可以得到Al2O3,而Na2SO3易被氧化,蒸干灼烧过程中Na2SO3被氧化成Na2SO4,故B错误;
C.常温下0.1mol•L-1的Na2A溶液的pH=10,A2-离子水解促进了水的电离,该溶液中氢氧根离子是水的电离的,则该溶液中由水电离的c(OH-)=10-4mol•L-1,故C错误;
D.常温下pH=2的盐酸和pH=12的氨水等体积混合后,混合液中氨水过量,溶液呈碱性,则c(H+)<c(OH-),根据电荷守恒可知:c(Cl-)<c(NH4+),所以c(Cl-)+c(H+)<c(NH4+)+c(OH-),故D正确;
故选D.
点评 本题考查较为综合,涉及溶液酸碱性与溶液pH的关系、盐的水解原理、弱电解质的电离、水的电离及其影响等知识,明确弱电解质的电离特点为解答关键,注意掌握水的电离及其影响,试题培养了学生的分析、理解能力及灵活应用能力.

练习册系列答案
相关题目
11.下列实验操作及对应解释或结论正确的是( )
| 选项 | 实验操作 | 解释或结论 |
| A | 向某溶液中滴加盐酸酸化的BaCl2溶液,出现白色沉淀 | 原溶液中一定含有SO42- |
| B | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 | Fe(OH)3的溶解度小于Mg(OH)2 |
| C | 用蒸馏水润湿的pH试纸测溶液的pH | 一定会使测定结果偏低 |
| D | 向混有乙酸和乙醇的乙酸乙酯中加入氢氧化钠溶液 | 除去溶液中的乙酸和乙醇 |
| A. | A | B. | B | C. | C | D. | D |
12.不能利用如图实验装置完成的实验是( )


| A. | 制取乙烯 | B. | 制取O2 | C. | 制取CO2 | D. | 制取乙炔 |
6.下列关于NO的说法正确的是( )
| A. | 为红棕色气体 | B. | 只有氧化性 | ||
| C. | 是汽车尾气的有害成分之一 | D. | 易溶于水生成硝酸 |
10.下述实验设计或操作正确的是( )
| 选项 | 实验目的 | 实验设计 |
| A | 除去铝箔上少量的氧化膜 | 将铝箔放入 NaOH 溶液中洗涤 |
| B | 排水法收集 KMnO4分解产生的 O2 | 先熄灭酒精灯,后移出导管 |
| C | 检验溶液中是否含有 Fe2+ | 向溶液中滴入氯水后,再滴加 KSCN 溶液 |
| D | 证明 H2SO4酸性比 H2CO3 强 | 把稀 H2SO4 滴入 NaHCO3 溶液 |
| A. | A | B. | B | C. | C | D. | D |
11.某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气.为了验证哪位同学的判断正确,丙同学设计了如图1所示实验装置(锌与浓硫酸共热时产生的气体为X,气体发生装置略去).试回答:
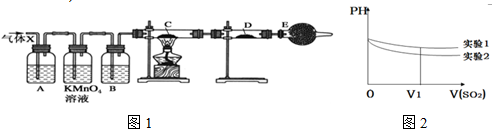
(1)上述反应中生成二氧化硫的化学方程式为Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O.
(2)乙同学认为还可能产生氢气的理由是在Zn与浓H2SO4反应过程中,H2SO4被消耗且有水生成,H2SO4浓度逐渐减小,变成稀硫酸,Zn与稀H2SO4反应生成H2.
(3)A中加入的试剂可能是品红溶液,作用是检验SO2;B中加入的试剂可能是浓H2SO4,作用是吸收水蒸气;
(4)可以证明气体X中含有氢气的实验现象是:C中:黑色(CuO)粉末变成红色(Cu),D中:白色粉末变成蓝色.
(5)II.该小组同学将收集的SO2气体通入0.1mol•L-1的Ba(NO3)2溶液中,得到了BaSO4沉淀,为探究上述溶液中何种微粒能氧化通入的SO2,该小组提出了如下假设:
假设一:溶液中的NO3-
假设二:溶液中溶解的O2
该小组设计实验验证了假设一,
(5)请在下表空白处填写相关实验现象
(6)为深入研究该反应,该小组还测得上述两个实验中溶液的pH随通入SO2体积的变化曲线如图2,实验1中溶液pH变小的原因是SO2溶于水后生成H2SO3,亚硫酸显酸性,故pH值减小V1时,实验2中溶液pH小于实验1的原因是(用离子方程式表示)3SO2+2H2O+2NO3- 2NO+4H++3SO42-;.
2NO+4H++3SO42-;.

(1)上述反应中生成二氧化硫的化学方程式为Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O.
(2)乙同学认为还可能产生氢气的理由是在Zn与浓H2SO4反应过程中,H2SO4被消耗且有水生成,H2SO4浓度逐渐减小,变成稀硫酸,Zn与稀H2SO4反应生成H2.
(3)A中加入的试剂可能是品红溶液,作用是检验SO2;B中加入的试剂可能是浓H2SO4,作用是吸收水蒸气;
(4)可以证明气体X中含有氢气的实验现象是:C中:黑色(CuO)粉末变成红色(Cu),D中:白色粉末变成蓝色.
(5)II.该小组同学将收集的SO2气体通入0.1mol•L-1的Ba(NO3)2溶液中,得到了BaSO4沉淀,为探究上述溶液中何种微粒能氧化通入的SO2,该小组提出了如下假设:
假设一:溶液中的NO3-
假设二:溶液中溶解的O2
该小组设计实验验证了假设一,
(5)请在下表空白处填写相关实验现象
| 实验步骤 | 实验现象 | 结论 |
| 实验1:在盛有不含O2的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 假设一成立 | |
| 实验2:在盛有不含O2的25ml0.1mol/LBa(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 |
 2NO+4H++3SO42-;.
2NO+4H++3SO42-;. 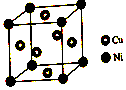 (1)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液
(1)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液
 甲醛是深受关注的有机化合物.甲醛含量的测定有多种方法,例如:在调至中性的亚硫酸钠溶液中加入甲醛水溶液,经充分反应后,产生的氢氧化钠的物质的量与甲醛的物质的量相等,然后用已知浓度的硫酸滴定氢氧化钠.
甲醛是深受关注的有机化合物.甲醛含量的测定有多种方法,例如:在调至中性的亚硫酸钠溶液中加入甲醛水溶液,经充分反应后,产生的氢氧化钠的物质的量与甲醛的物质的量相等,然后用已知浓度的硫酸滴定氢氧化钠.