题目内容
3.在实验室中,下列除去杂质的方法不正确的是( )| A. | 溴苯中混有溴,加稀氢氧化钠反复洗涤、分液 | |
| B. | 乙烯中混有SO2、CO2,将其通入NaOH溶液洗气 | |
| C. | 除去CO2中少量的SO2:气体通过盛饱和碳酸氢钠溶液的洗气瓶 | |
| D. | 乙烷中混有乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷 |
分析 A.溴与NaOH溶液反应后,与溴苯分层;
B.SO2、CO2均与NaOH溶液反应,而乙烯不能;
C.二氧化硫与碳酸氢钠溶液反应生成二氧化碳;
D.易引入新杂质氢气.
解答 解:A.溴与NaOH溶液反应后,与溴苯分层,则加稀氢氧化钠反复洗涤、分液可除杂,故A正确;
B.SO2、CO2均与NaOH溶液反应,而乙烯不能,则将其通入NaOH溶液、洗气可分离,故B正确;
C.二氧化硫与碳酸氢钠溶液反应生成二氧化碳,则气体通过盛饱和碳酸氢钠溶液的洗气瓶可分离,故C正确;
D.易引入新杂质氢气,不能除杂,应选溴水、洗气,故D错误;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、性质差异、混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意元素化合物的性质及应用,题目难度不大.

练习册系列答案
相关题目
14.下列递变规律正确的是( )
| A. | HClO4、H3PO4、H2SO4的酸性依次减弱 | |
| B. | HCl、HBr、HI的稳定性依次减弱 | |
| C. | N、O、F原子半径逐渐增大 | |
| D. | 钠、镁、铝的还原性依次减弱 |
11.常温下,物质的量浓度相等的下列溶液pH由大到小的顺序是( )
①Na2CO3②CH3COONa ③CH3CH2ONa ④NH4NO3⑤NaHSO4⑥苯酚钠 ⑦NaHCO3.
①Na2CO3②CH3COONa ③CH3CH2ONa ④NH4NO3⑤NaHSO4⑥苯酚钠 ⑦NaHCO3.
| A. | ③①⑥⑦②④⑤ | B. | ⑥①②⑦③④⑤ | C. | ⑤④③①⑥⑦② | D. | ⑥③⑦①②④⑤ |
8.关于烃的反应表达式:CnHm(g)+(n+$\frac{m}{4}$ )O2 $\stackrel{点燃}{→}$ nCO2+$\frac{m}{2}$ H2O(g),下列说法不正确的是( )
| A. | 可用于计算烃完全燃烧时的耗氧量 | B. | 式中的m只可能是大于0的偶数 | ||
| C. | 式中的m不可能是小于n | D. | 所表示的反应一定是放热反应 |
12.如图有关于化学反应速率和化学平衡的四个图象,下列反应中全部符合上述图象的反应是( )
| A. | 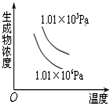 4NH3(g)+5O2(g)?4NO+6H2O(g);△H=-Q1kJ/mol(Q1>0) | |
| B. | 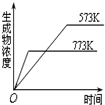 2SO3(g)?2SO2(g)+O2(g);△H=+Q2 kJ/mol(Q2>0) | |
| C. |  N2(g)+3H2(g)?2NH3(g);△H=-Q3kJ/mol(Q3>0) | |
| D. | 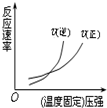 H2(g)+CO(g)?C(s)+H2O(g);△H=+Q4kJ/mol(Q4>0) |
3. 有A、B、C、D、E五种元素,其相关信息如表:
有A、B、C、D、E五种元素,其相关信息如表:
请回答下列问题:
(1)写出E元素原子基态时的电子排布式1s22s22p63s23p63d104s1.
(2)C元素的第一电离能比氧元素的第一电离能大(填“大”或“小”).
(3)CA3分子中C原子的杂化类型是sp3.
(4)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有①③(填序号);
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为a(填序号).
a.平面正方形 b.正四面体 c.三角锥形 d.V形
(5)B与D可形成离子化合物,其晶胞结构如图所示.其中D离子的配位数为8,若该晶体的密度为a g•cm-3,则该晶胞的体积是$\frac{\frac{78}{{N}_{A}}×4}{a}$ cm3(写出表达式即可).
 有A、B、C、D、E五种元素,其相关信息如表:
有A、B、C、D、E五种元素,其相关信息如表:| 元素 | 相关信息 |
| A | A原子的1s轨道上只有1个电子 |
| B | B是电负性最大的元素 |
| C | C基态原子的2p轨道中有3个未成对电子 |
| D | D是主族元素且与E同周期,其最外能层 上有2个运动状态不同的电子 |
| E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
(1)写出E元素原子基态时的电子排布式1s22s22p63s23p63d104s1.
(2)C元素的第一电离能比氧元素的第一电离能大(填“大”或“小”).
(3)CA3分子中C原子的杂化类型是sp3.
(4)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有①③(填序号);
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为a(填序号).
a.平面正方形 b.正四面体 c.三角锥形 d.V形
(5)B与D可形成离子化合物,其晶胞结构如图所示.其中D离子的配位数为8,若该晶体的密度为a g•cm-3,则该晶胞的体积是$\frac{\frac{78}{{N}_{A}}×4}{a}$ cm3(写出表达式即可).