题目内容
5.化学与生活密切相关,下列说法错误的是( )| A. | 小苏打可以与胃酸反应,可用小苏打治疗胃酸过多 | |
| B. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果发生了加成反应 | |
| C. | 食品脱氧剂(含铁粉、氯化钠、炭粉等)的脱氧原理与钢铁的吸氧腐蚀相同 | |
| D. | 加人足量氢氧化钠溶液共热.能区别地沟油(加工过的餐饮废弃油)与矿物油(汽油、煤油、柴油等) |
分析 A.小苏打为碳酸氢钠,能够与盐酸反应,消耗盐酸;
B.乙烯具有催熟作用,高锰酸钾能够氧化乙烯;
C.食品脱氧剂的脱氧以及钢铁的吸氧腐蚀都发生原电池反应;
D.地沟油中含油脂,与碱溶液反应,而矿物油不与碱反应,混合后分层.
解答 解:A.小苏打为碳酸氢钠,能够与盐酸反应,消耗盐酸,所以小苏打可以与胃酸反应,可用小苏打治疗胃酸过多,故A正确;
B.所以用浸泡过高锰酸钾溶液的硅藻土保鲜水果发生了氧化反应,故B错误;
C.食品脱氧剂的脱氧以及钢铁的吸氧腐蚀都发生原电池反应,故C正确;
D.加入足量氢氧化钠溶液共热,不分层的是地沟油,分层的为矿物油,现象不同,能区别,故D正确;
故选:B.
点评 本题考查了元素化合物知识,侧重考查有关物质的用途,明确相关物质的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
15.硅是信息高速公路的基石,通常以硅石(SiO2>99.0%、还有少量的Al2O3、Fe2O3等)为主要原料制备,主要流程如图所示.
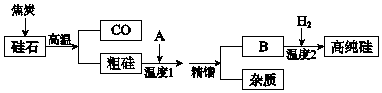
(1)从硅石中得到粗硅的化学方程式是SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,粗硅含有的杂质有铝、铁等.
(2)二氧化硅与焦炭在高温下也能得到一种硬度仅次于金刚石的物质金刚砂(化学式为SiC,Si为+4价),原理是SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑,该反应中的氧化剂是碳.
(3)若A是氯气,B是四氯化硅,精馏得到纯净SiCl4,温度应控制的范围是a(填序号).
a.55~60℃b.180~200℃c.300~320℃
则精馏分离出的杂质成分是FeCl3、AlCl3.
(4)若A是HCl,B是SiHCl3,生产过程中可循环利用的物质是HCl.

(1)从硅石中得到粗硅的化学方程式是SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,粗硅含有的杂质有铝、铁等.
(2)二氧化硅与焦炭在高温下也能得到一种硬度仅次于金刚石的物质金刚砂(化学式为SiC,Si为+4价),原理是SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑,该反应中的氧化剂是碳.
(3)若A是氯气,B是四氯化硅,精馏得到纯净SiCl4,温度应控制的范围是a(填序号).
| 物质 | SiCl4 | SiHCl3 | FeCl3 | AlCl3 |
| 熔点/℃ | -70 | -128.2 | 306 | -- |
| 沸点/℃ | 57.6 | 31.85 | 315 | 181 升华 |
则精馏分离出的杂质成分是FeCl3、AlCl3.
(4)若A是HCl,B是SiHCl3,生产过程中可循环利用的物质是HCl.
13.N4最初由罗马大学的Fulvio Cacace及其同事发现,向一恒容、绝热的密闭容器中加入一定量的N2和H2,发生如下反应:①N2(g)+3H2(g)?2NH3(g)△H1=-92.2kJ•mol;②4NH3(g)?N4(g)+6H2(g)△H2=+1066.4kJ•mol;③2N2(g)?N4(g)△H3.以下有关说法正确的是( )
| A. | 反应③为放热反应 | |
| B. | 当容器内湿埋不再变化时,上述各反应均达到化学平衡状态 | |
| C. | 当混合气体的密度不再变化时,上述各反应均达到化学平衡状态 | |
| D. | 若反应①的平衡常数为K1,反应②的平衡常数为K2,则反应③的平衡常数K3=2K1•K2 |
20.下列物质的应用或现象解释错误的是( )
| A. | 废旧电池必须回收,主要目的是回收其中的金属 | |
| B. | “从沙滩到用户”,计算机芯片的材料是指单质硅 | |
| C. | 利用风能,太阳能等清洁能源代替化石燃料,可减少环境污染 | |
| D. | “光化学烟雾”,“硝酸型酸雨”的形成都与氮氧化物有关 |
11.下列溶液中Cl-的物质的量浓度最大的是( )
| A. | 200mL 2mol/L MgCl2溶液 | B. | 1000mL 2.5mol/L NaCl溶液 | ||
| C. | 250mL 1mol/L AlCl3溶液 | D. | 300mL 5mol/L KCl溶液 |
8.下列说法正确的是( )
| A. | 苯萃取碘水中的I2,分出水层的操作为从上口倒出 | |
| B. | 在未知溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知溶液中存在SO42-或SO32- | |
| C. | 做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸.如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加 | |
| D. | 配制245mL0.1 mol•L-1的NaOH溶液,需要245mL容量瓶 |
9.根据元素的核电荷数,不能确定的是( )
| A. | 原子核内质子数 | B. | 原子核中子数 | ||
| C. | 原子的最外层电子数 | D. | 原子的电子总数 |