题目内容
7.下列离子方程式正确的是( )| A. | 氯化铵溶液呈酸性:NH4+═NH3+H+ | |
| B. | 氢硫酸的电离:H2S?2H++S2-? | |
| C. | 向小苏打溶液中加入醋酸溶液:HCO3-+H+?CO2+H2O | |
| D. | 在标准状况下,向10 mL 0.1 mol•L-1 FeBr2溶液中通入22.4 mL Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
分析 A.铵根离子在溶液中部分水解生成一水合氨和氢离子,溶液呈酸性;
B.氢硫酸为二元弱酸,其电离方程式需要分步书写,主要以第一步为主;
C.醋酸为弱酸,离子方程式中醋酸不能拆开,不能用可逆号,且没有用气体符号;
D.亚铁离子的还原性大于溴离子,亚铁离子优先被氧化,计算出亚铁离子、溴离子、氯气的物质的量,然后判断过量情况及反应产物.
解答 解:A.氯化铵溶液呈酸性的原因,是弱离子的水解,离子方程式为:NH4++H2O?NH3•H2O+H+,故A错误;
B.氢硫酸的电离分步进行,主要以第一步为主,其正确的电离方程式为:H2S?H++HS-,故B错误;
C.向小苏打溶液中加入醋酸溶液生成醋酸钠、二氧化碳气体和水,正确的离子方程式为:HCO3-+CH3COOH=CO2↑+H2O+CH3COO-,故C错误;
D.10 mL 0.1 mol•L-1FeBr2溶液中含有0.001molFeBr2,含有0.001mol亚铁离子、0.002mol溴离子,标准状况下22.4mL氯气的物质的量为0.001mol,亚铁离子优先被氧化,0.001mol亚铁离子完全反应消耗0.0005mol氯气,剩余的0.0005mol氯气能够氧化0.001mol溴离子,则反应的离子方程式为:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-,故D正确;
故选D.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,如:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
17.用来证明淀粉部分水解的试剂是( )
①碘水 ②KI溶液 ③银氨溶液 ④FeCl3溶液.
①碘水 ②KI溶液 ③银氨溶液 ④FeCl3溶液.
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
18.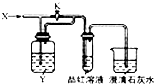 向图所示的装置中缓慢通入气体X,若打开活塞K,品红溶液褪色;若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊.X和Y可能是( )
向图所示的装置中缓慢通入气体X,若打开活塞K,品红溶液褪色;若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊.X和Y可能是( )
 向图所示的装置中缓慢通入气体X,若打开活塞K,品红溶液褪色;若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊.X和Y可能是( )
向图所示的装置中缓慢通入气体X,若打开活塞K,品红溶液褪色;若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊.X和Y可能是( ) | A | B | C | D | |
| X | SO2 | Cl2 | HCl | NO2 |
| Y | NaOH溶液 | 饱和NaCO3溶液 | 饱和NaCl溶液 | Na2SO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
15.下列关于物质分类的表述,正确的说法是( )
| A. | 根据分散质粒子能否透过滤纸,可以将分散系分为溶液、胶体和浊液 | |
| B. | 根据某物质中是否含有氢元素,判断该物质是否属于酸 | |
| C. | 根据化学反应前后,是否有电子转移,判断反应是否属于氧化还原反应 | |
| D. | 根据某物质中是否含有氧元素,可以判断该物质是否属于氧化物 |
2.下列反应中,不属于氧化还原反应的是( )
| A. | 2Na+2H2O=2NaOH+H2↑ | B. | 3NO2+H2O=2HNO3+NO | ||
| C. | 2Al+2NaOH+6H2O=2NaAlO2+3H2↑ | D. | CaCO3=CaO+CO2↑ |
12.如表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准).
(1)下列化合物与氯化氢加成时,取代基对速率的影响与表中规律类似,其中反应速率最快的是A(填序号).
A.(CH3)2C=C(CH3)2 B.CH3CH=CHCH2CH3
C.CH2=CH CH3 D.CH2=CHCl
(2)烯烃与溴化氢、水加成时,产物有主次之分,例如:
CH2=CHCH3+HBr→CH3CHBrCH3+CH3CH2Br
(主要产物)(次要产物)
CH2=CHCH2CH3+H2O$\stackrel{H+}{→}$CH3CH(OH)CH2CH3+CH3CH2CH2CH2OH
(主要产物) (次要产物)
请写出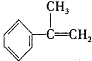 与HBr反应的主要产物的结构简式
与HBr反应的主要产物的结构简式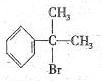 .
.
(3)禽流感在全球的蔓延,使人们谈“禽”色变.从香料八角中提取的莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一,达菲是抗禽流感病毒特效药物.
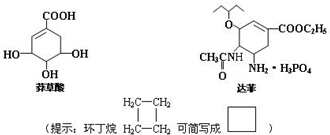
a.莽草酸分子中含有的官能团有羧基、羟基、碳碳双键;
b.莽草酸在浓硫酸作用下加热可以得到B(B的结构简式为: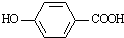 ),其反应类型为:消去反应;
),其反应类型为:消去反应;
c.请写出莽草酸与乙醇反应的化学方程式(有机物用结构简式表示):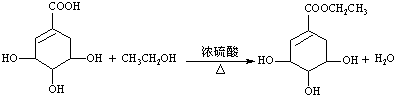 .
.
| 烯类化合物 | 相对速率 |
| (CH3)2C=CHCH3 | 10.4 |
| CH3CH=CH2 | 2.03 |
| CH2=CH2 | 1.00 |
| CH2=CHBr | 0.04 |
A.(CH3)2C=C(CH3)2 B.CH3CH=CHCH2CH3
C.CH2=CH CH3 D.CH2=CHCl
(2)烯烃与溴化氢、水加成时,产物有主次之分,例如:
CH2=CHCH3+HBr→CH3CHBrCH3+CH3CH2Br
(主要产物)(次要产物)
CH2=CHCH2CH3+H2O$\stackrel{H+}{→}$CH3CH(OH)CH2CH3+CH3CH2CH2CH2OH
(主要产物) (次要产物)
请写出
 与HBr反应的主要产物的结构简式
与HBr反应的主要产物的结构简式 .
.(3)禽流感在全球的蔓延,使人们谈“禽”色变.从香料八角中提取的莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一,达菲是抗禽流感病毒特效药物.

a.莽草酸分子中含有的官能团有羧基、羟基、碳碳双键;
b.莽草酸在浓硫酸作用下加热可以得到B(B的结构简式为:
 ),其反应类型为:消去反应;
),其反应类型为:消去反应;c.请写出莽草酸与乙醇反应的化学方程式(有机物用结构简式表示):
 .
.
19.下列实验操作都能够达到预期目的是( )
①用pH试纸测得某溶液pH为3.5
②用米汤直接检验食用盐中是否含有碘元素
③用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸
④滴入酚酞溶液确定纯碱中有无烧碱
⑤用酸式滴定管量取20.00mL高锰酸钾酸性溶液
⑥蒸干AlCl3溶液可得纯净的无水氯化铝.
①用pH试纸测得某溶液pH为3.5
②用米汤直接检验食用盐中是否含有碘元素
③用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸
④滴入酚酞溶液确定纯碱中有无烧碱
⑤用酸式滴定管量取20.00mL高锰酸钾酸性溶液
⑥蒸干AlCl3溶液可得纯净的无水氯化铝.
| A. | ②④⑥ | B. | ②⑥ | C. | ⑤ | D. | ④⑤⑥ |
16.下列有关物质分类和氧化还原的描述正确的是( )
| A. | 酸性氧化物一定是非金属氧化物,混合物、分散系、胶体有从属关系 | |
| B. | 元素的单质可由氧化或还原含该元素的化合物来制得 | |
| C. | 得电子越多的氧化剂,其氧化性就越强;含最高价元素的化合物一定具有强的氧化性 | |
| D. | 烧碱、熟石灰均属于碱,酸、碱、盐之间发生的反应均属于复分解反应 |
17.下列属于吸热反应同时又属于氧化还原反应的是( )
| A. | 点燃的镁条在二氧化碳中继续燃烧 | B. | Ca(OH)2与NH4Cl的反应 | ||
| C. | 灼热的碳与二氧化碳的反应 | D. | 酸碱中和反应 |