题目内容
常温下,将NaHY晶体加入水中溶解,得到0.1 mol/L NaHY溶液,下列叙述正确的是( )
| A.若NaHY溶液的pH=4,该溶液中粒子浓度关系为:c(Na+)>c(HY-)>c(H+)>c(Y2-)>c(H2Y) |
| B.若NaHY的水溶液显碱性,该溶液中粒子浓度关系为:c(Na+)>c(OH-)>c(H+)>c(HY-) |
| C.若溶液中粒子浓度关系为c(H+)+c(H2Y)=c(OH-)+c(Y2-),则NaHY的水溶液一定显碱性 |
| D.将NaHY晶体加入水中一定能促进水的电离 |
A
解析

练习册系列答案
 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
在室温下等体积的酸和碱的溶液,混合后pH一定小于7的是 ,
| A.pH=3的硝酸和pH=11的氢氧化钠溶液 |
| B.pH=3的盐酸和pH=11的氨水 |
| C.pH=3的硫酸和pH=11的氢氧化钠溶液 |
| D.pH=3的醋酸和pH=11的氢氧化钠溶液 |
将下列气体通入水中,其饱和水溶液酸性最强的是
| A.CH4 | B.NH3 | C.HBr | D.SO2 |
下列电解质溶液的有关叙述正确的是
| A.同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 |
| B.在含有BaSO4沉淀的溶液中加入K2SO4固体,c(Ba2+)增大 |
| C.含l mol KOH的溶液与l mol CO2完全反应后,溶液中c(K+)>c(HCO3-) |
| D.在(NH4)2SO4溶液中加入适量H2SO4,可使c(NH4+)=2c(SO42-) |
已知298 K时下列物质的溶度积(单位略)。
| | CH3COOAg | AgCl | Ag2CrO4 | Ag2S |
| Ksp | 2.3×10-3 | 1.77×10-10 | 1.12×10-12 | 6.7×10-15 |
下列说法正确的是( )
A.等体积、浓度均为0.02 mol·L-1的CH3COONa和AgNO3溶液混合能产生沉淀
B.向含有浓度均为0.01 mol·L-1的CrO42—和Cl-的溶液中慢慢滴入AgNO3溶液时,CrO42—先沉淀
C.在CH3COOAg悬浊液中加入盐酸时发生反应的离子方程式为CH3COOAg+H++Cl-=CH3COOH+AgCl
D.298 K时,上述四种饱和溶液的物质的量浓度: c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S)
下列说法正确的是( )
| A.常温下将pH=2的醋酸和pH=12的NaOH溶液等体积混合,所得溶液显碱性 |
| B.已知同温时氢氟酸的电离常数大于亚硝酸的电离常数,则相同温度相同浓度的NaF溶液和NaNO2溶液的碱性:NaF溶液较强 |
| C.将等体积的盐酸和氨水混合,充分反应后所得溶液呈中性,则两溶液的物质的量浓度关系为:c(HCl)<c(NH3·H2O) |
| D.已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)= c(CO32-),且c(Mg2+)·c(CO32-)=6.82×10-6 |
下列液体均处于25 ℃,有关叙述正确的是 ( )。
| A.某物质溶液的pH>7,则该物质一定是碱或强碱弱酸盐 |
| B.pH=6.5的牛奶中c(H+)是pH=4.5的H2SO4溶液中c(H+)的100倍 |
| C.pH=3的醋酸与pH=11的NaOH溶液等体积混合后溶液中: c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D.AgCl在等浓度的CaCl2溶液和NaCl溶液中的溶解度相同 |
常温下,0.1 mol·L-1某一元酸HA溶液中 =1×10-12,下列说法中正确的是( )
=1×10-12,下列说法中正确的是( )
| A.溶液中由水电离出的c(H+)=1×10-10 mol·L-1 |
B.溶液中存在HA H++A- H++A- |
| C.与0.1 mol·L-1 NaOH溶液等体积混合后所得溶液为中性 |
| D.原溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大 |
常温下,有关醋酸溶液的叙述中错误的是(双选) ( )。
| A.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) |
B.将pH=3的醋酸稀释为pH=4的过程中,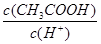 比值不变 比值不变 |
| C.浓度均为0.1 mol·L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| D.a mL pH=3的醋酸溶液与b mL pH=11的NaOH溶液恰好完全中和时,a=b |