题目内容
已知0.5L盐酸和硫酸的混合溶液中含有0.1mol Cl-和0.2mol SO42-,则此溶液中H+的物质的量浓度是( )
| A.1 mol/L | B.0.5 mol/L | C.0.6 mol/L | D.0.1 mol/L |
0.5L盐酸和硫酸的混合溶液中含有0.1mol Cl-和0.2mol SO42-,
根据电荷守恒溶液中n(H+)=n(Cl-)+2n(SO42-)=0.1mol+2×0.2mol=0.5mol,
故溶液中氢离子的浓度为:
=1mol/L,
故选A.
根据电荷守恒溶液中n(H+)=n(Cl-)+2n(SO42-)=0.1mol+2×0.2mol=0.5mol,
故溶液中氢离子的浓度为:
| 0.5mol |
| 0.5L |
故选A.

练习册系列答案
相关题目
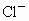 和0.2mol
和0.2mol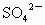 ,则此溶液中
,则此溶液中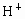 的物质的量浓度
的物质的量浓度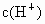 为
为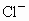 和0.2mol
和0.2mol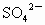 ,则此溶液中
,则此溶液中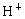 的物质的量浓度
的物质的量浓度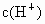 为
为