题目内容
19.下列有关化学用语的表达中正确的是( )| A. | 四氯化碳的电子式: | |
| B. | CH4分子的比例模型 | |
| C. |  和 和 互为同系物 互为同系物 | |
| D. | 稀硝酸银溶液中滴加过量稀氨水,发生反应的离子方程式为Ag++2NH3•H2O=[Ag(NH3)2]++2H2O |
分析 A.Cl原子最外层为8电子稳定结构;
B.甲烷为正四面体;
C. 为醇,
为醇, 为酚;
为酚;
D.发生络合反应,生成银氨溶液.
解答 解:A.四氯化碳的电子式为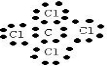 ,故A错误;
,故A错误;
B.甲烷为正面体结构,由原子相对大小表示空间结构为比例模型,则CH4分子的比例模型为 ,故B错误;
,故B错误;
C. 为醇,
为醇, 为酚,为不同类别的物质,故C错误;
为酚,为不同类别的物质,故C错误;
D.稀硝酸银溶液中滴加过量稀氨水,发生反应的离子方程式为Ag++2NH3•H2O=[Ag(NH3)2]++2H2O,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重络合反应的离子反应等化学用语的考查,题目难度不大.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
9.下列关于有机物结构、性质的说法正确的是( )
| A. | 石油裂解的主要目的是提高汽油等轻质油的产量与质量,石油催化裂化的主要目的是得到更多的乙烯、丙烯等气态短链烃 | |
| B. | 分子式为C3H7C1的有机物有三种同分异构体 | |
| C. | 甲烷、苯、乙醇、乙酸和乙酸乙酯在一定条件下都能发生取代反应 | |
| D. | 向蛋白质溶液中加入浓的Na2SO4或CuSO4溶液均可使蛋白质盐析而分离提纯 |
7. 普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述正确的是( )
 普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述正确的是( )| A. | 能与FeCl3 溶液发生显色反应 | |
| B. | 能使酸性KMnO4 溶液褪色 | |
| C. | 能发生加成、取代,不能消去反应 | |
| D. | 1 mol 该物质最多可与1 mol NaOH 反应 |
14.下列除去杂质的方法正确的是( )
| A. | KNO3溶液中混有少量K2SO4,加入适量BaCl2溶液 | |
| B. | 二氧化碳气体中混有少量二氧化硫:通入酸性高锰酸钾溶液,收集气体 | |
| C. | 除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤 | |
| D. | 除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤 |
4.下列说法中正确的是( )
| A. | 随着原子序数的递增,第三周期元素的电负性逐渐减小 | |
| B. | 铝的第一电离能比镁的第一电离能大 | |
| C. | K、Na、Li的第一电离能逐渐增大 | |
| D. | 电负性差值大的元素原子之间形成的化学键主要是共价键 |
1.下列解释事实的化学方程式不正确的是( )
| A. | 金属钠在空气中加热,生成淡黄色固体:2Na+O2═Na2O2 | |
| B. | 向硫酸铝溶液中加入氨水制备氢氧化铝:Al3++3NH3•H2O=Al(OH)3↓+3$N{{H}_{4}}^{+}$ | |
| C. | 铁在潮湿的环境中生锈:3Fe+4H2O=Fe3O4+H2↑ | |
| D. | 二氧化氮溶于水有硝酸生成:3NO2+H2O=2HNO3+NO |
2.央视《每周质量报告》报道某著名制药企业使用工业明胶制造有毒胶囊,其中铬元素含量超标.铬是人体必需的微量元素,它与脂类代谢有密切关系,能增强人体内胆固醇的分解和排泄.但铬过量会引起污染,危害人类健康.不同价态的铬毒性不同,三价铬对人体几乎无毒,六价铬的毒性为三价铬的100倍.工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大危害,必须进行处理.一种处理方法的工艺流程为

回答下列问题:
(1)初沉池中加入的混凝剂是明矾,用于吸附悬浮杂质,用离子方程式表示其道理Al3++3H2O?Al(OH)3+3H+.
(2)若在化学实验室中模拟第②步操作A,则进行该操作所需的玻璃仪器为烧杯、漏斗、玻璃棒.
(3)已知在其中第③步存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O
若平衡体系的pH=1,该溶液是橙色;能说明第③步反应达平衡状态的是C(填序号).
A.Cr2O72-与CrO42-的浓度相同
B.2v(Cr2O72-)=v(CrO42-)
C.溶液的颜色不变
(4)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,且有关离子完全沉淀的pH如下表:
在操作④和操作⑤中,加入Fe2SO4,再调节pH,使Fe3+和Cr3+完全沉淀.则可用于调节溶液pH的最佳试剂为C填序号.
A.Na2O2 B.Ba(OH)2 C.NaOH
此时溶液pH的范围在B(填序号)最好.
A.3-4 B.6-8 C.10-11 D.12-14.
(5)若按照(4)题方法处理Cr2O72-,则处理该溶液中0.1molCr2O72-时,理论上可生成沉淀的质量为84.8g.
(6)工业上还可以用石墨作电极,电分解Na2CrO4的酸性废水来生产金属铬,写出生成金属铬的电极反应式CrO42-+8H++6e-=Cr+4H2O.

回答下列问题:
(1)初沉池中加入的混凝剂是明矾,用于吸附悬浮杂质,用离子方程式表示其道理Al3++3H2O?Al(OH)3+3H+.
(2)若在化学实验室中模拟第②步操作A,则进行该操作所需的玻璃仪器为烧杯、漏斗、玻璃棒.
(3)已知在其中第③步存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O
若平衡体系的pH=1,该溶液是橙色;能说明第③步反应达平衡状态的是C(填序号).
A.Cr2O72-与CrO42-的浓度相同
B.2v(Cr2O72-)=v(CrO42-)
C.溶液的颜色不变
(4)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,且有关离子完全沉淀的pH如下表:
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀时的pH | 9.0 | 3.2 | 5.6 |
A.Na2O2 B.Ba(OH)2 C.NaOH
此时溶液pH的范围在B(填序号)最好.
A.3-4 B.6-8 C.10-11 D.12-14.
(5)若按照(4)题方法处理Cr2O72-,则处理该溶液中0.1molCr2O72-时,理论上可生成沉淀的质量为84.8g.
(6)工业上还可以用石墨作电极,电分解Na2CrO4的酸性废水来生产金属铬,写出生成金属铬的电极反应式CrO42-+8H++6e-=Cr+4H2O.