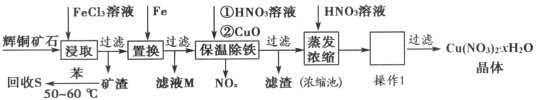
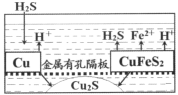
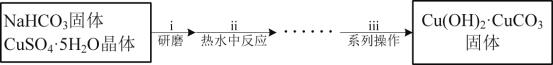
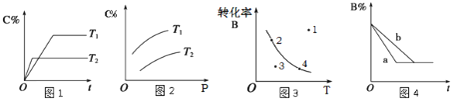
题目内容
【题目】物质的量浓度相等的三种溶液:①H2CO3 ②NaOH ③Na2CO3溶液,下列说法不正确的是( )
A.水电离出的c(H+):③>①>②
B.溶液的pH:②>③>①
C.①和②等体积混合后的溶液:![]()
D.①和③等体积混合后的溶液:![]()
【答案】D
【解析】
A.酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中氢离子浓度越大、碱中氢氧根离子浓度越大,对水的电离的抑制程度越大,据此判断;
B.NaOH是强碱、碳酸钠是强碱弱酸盐、碳酸是弱酸,据此排序;
C.①和②等体积等浓度混合后的溶液中溶质为碳酸氢钠,碳酸氢根离子水解程度大于其电离程度,结合物料守恒判断;
D.①和③等体积等浓度混合后的溶液中溶质为碳酸氢钠,碳酸氢根离子水解程度大于其电离程度,据此分析判断。
A.酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中氢离子浓度越大、碱中氢氧根离子浓度越大,对水的电离的抑制程度越大,①H2CO3为弱酸,②NaOH为强碱,③Na2CO3溶液为能够水解的盐,所以水电离出c(H+):③>①>②,故A正确;
B.NaOH是强碱、碳酸钠是强碱弱酸盐、碳酸是弱酸,所以pH:②>③>①,故B正确;
C.①和②等体积等浓度混合后的溶液中溶质为碳酸氢钠,碳酸氢根离子水解程度大于其电离程度,溶液呈碱性,根据物料守恒得![]() ,故C正确;
,故C正确;
D.①和③等体积等浓度混合后的溶液中溶质为碳酸氢钠,碳酸氢根离子水解程度大于其电离程度,溶液呈碱性,碳酸氢根离子水解和水的电离都生成氢氧根离子,只有碳酸氢根离子电离生成碳酸根离子,所以离子浓度大小顺序是![]() ,故D错误;
,故D错误;
故选D。

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目