题目内容
4.燃料电池是利用燃料(如H2、CO、CH4等)跟氧气反应从而将化学能转化成电能的装置.下列关于甲烷燃料电池(NaOH溶液作电解质溶液)的说法中正确的是( )| A. | 负极反应为O2+2H2O+4e-=4OH- | |
| B. | 放电时正极发生氧化反应,外电路中电子从正极流向负极 | |
| C. | 负极反应为CH4+10OH--8e-=CO32-+7H2O | |
| D. | 随着放电的进行,溶液的pH增大 |
分析 燃料电池是燃料跟O2(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱(如NaOH)溶液,燃料气体通入的是原电池的负极失电子发生氧化反应,氧气通入的是正极发生还原反应;负极的电极反应式为:CH4+10OH--8e-═CO32-+7H2O,通氧气的电极为正极,正极反应为O2+2H2O+4e-=4OH-;总化学方程式为:CH4+2O2+2OH-=CO32-+3H2O,据此进行分析.
解答 解:A.通氧气的电极为正极,正极反应为:O2+2H2O+4e-=4OH-,故A错误;
B.放电时正极上氧气得电子发生还原反应,外电路中电子从负极流向正极,故B错误;
C.通入甲烷的一极为负极发生氧化反应,碱性条件下甲烷失电子生成碳酸根离子和水,其电极反应为CH4+10OH--8e-=CO32-+7H2O,故C正确;
D.甲烷燃料电池中总反应为:CH4+2O2+2OH-=CO32-+3H2O,原电池反应中消耗氢氧根离子,所以氢氧根离子浓度减小,则电解质溶液的pH减小,故D错误;
故选C.
点评 本题考查了燃料电池的原理,主要涉及电极名称、电极反应式的书写、电极反应的判断和应用,题目难度不大,明确原电池工作原理为解答关键,试题培养了学生了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
14.下列叙述中正确的是( )
| A. | 用C8H18萃取溴水中的溴,可观察到溶液分层,上层为橙红色,下层接近无色 | |
| B. | 有机物一定含碳、氢元素,可能含有氧、硫等元素 | |
| C. | 在石油的分馏实验中,温度计的水银球插入石油中以测液体的温度 | |
| D. | 石油的裂化、裂解、分馏与煤的干馏均属于化学变化 |
12.在一个固定体积的密闭容器中,加入2mol A和1mol B发生如下反应:2A(g)+B(g)?3C(g)+D(g),达到平衡时,C的浓度为W mol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为W mol/L的是( )
| A. | 4molA+2molB | B. | 1.5molC+0.5molD | ||
| C. | 1molB+1molD | D. | 1molA+0.5molB+1.5molC+0.5molD |
19.对于碳原子数小于或等于 6 的烃,下列说法中正确的是( )
| A. | C2H4 的结构简式可表示为 CH2CH2 | |
| B. | 6 个碳原子形成的烃分子中,最多有5个C-C单键 | |
| C. | C6H6 分子中,所有原子均可能在同一平面内 | |
| D. | C3H6 分子中一定含有 |
14.面对日益严重的资源短缺及环境污染问题,“变废为宝”成为化学发展的新方向.废旧酸性锌锰干电池经分离破碎后的锰粉含Mn02、Mn0(0H)、Zn(NH3)CL2、Fe、NH4C1和炭黑等,可用于制取Mn02高性能磁性材料MnC03,其工艺流程如下:
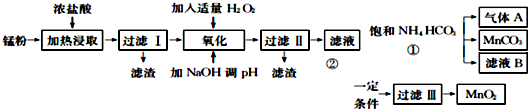
已知几种氢氧化物开始沉淀和完全沉淀的pH如表:
回答下列问题:
(1)过滤工得到的滤渣主要成分是碳黑.
(2)滤液经氧化后加入NaOH溶液调节pH至8.5〜8.8,其目的是除去Fe3+、Zn2+.
(3)过滤Ⅱ得到的滤液中含有的阳离子主要是Mn2+、NH4+、Na+(填离子符号).
(4)过程①中发生反应的离子方程式为Mn2++2HCO3-=MnCO3+CO2↑+H2O,对气体A和滤液B应采取的处理方法分别是CO2循环利用,用于生产NH4HCO3;滤液B中含有NH4Cl,可分离用作氮肥.
(5)过程②得到MnO2.将MnO2成悬浊液,通S02还原可得MnSO4,再加入Na2CO3或NaHCO3,也可制备MnCO3.SO2还原MnO2的化学方程式为MnO2+S02=MnSO4,向MnS04溶液中加入Na2C03或NaHC03制备MnC03时应注意的问题是边搅拌边加入Na2C03或NaHC03,并控制溶液的pH<8.8.

已知几种氢氧化物开始沉淀和完全沉淀的pH如表:
| 氢氧化物 | Fe(OH) | Fe(OH) | Mn0H)2 | Zn(OH)2 |
| 开始沉淀的pH | 7.5 | 2.2 | 8.8 | 6.4 |
| 沉淀完全的pH | 9.5 | 3.7 | 10.8 | 8.5 |
(1)过滤工得到的滤渣主要成分是碳黑.
(2)滤液经氧化后加入NaOH溶液调节pH至8.5〜8.8,其目的是除去Fe3+、Zn2+.
(3)过滤Ⅱ得到的滤液中含有的阳离子主要是Mn2+、NH4+、Na+(填离子符号).
(4)过程①中发生反应的离子方程式为Mn2++2HCO3-=MnCO3+CO2↑+H2O,对气体A和滤液B应采取的处理方法分别是CO2循环利用,用于生产NH4HCO3;滤液B中含有NH4Cl,可分离用作氮肥.
(5)过程②得到MnO2.将MnO2成悬浊液,通S02还原可得MnSO4,再加入Na2CO3或NaHCO3,也可制备MnCO3.SO2还原MnO2的化学方程式为MnO2+S02=MnSO4,向MnS04溶液中加入Na2C03或NaHC03制备MnC03时应注意的问题是边搅拌边加入Na2C03或NaHC03,并控制溶液的pH<8.8.

 钢铁工业是国民经济的重要基础产业,是国家经济水平和综合国力的重要标志,高炉炼铁是最为普遍的一种炼铁方法.
钢铁工业是国民经济的重要基础产业,是国家经济水平和综合国力的重要标志,高炉炼铁是最为普遍的一种炼铁方法.