题目内容
19.电解原理在化学工业中有广泛应用.图1表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
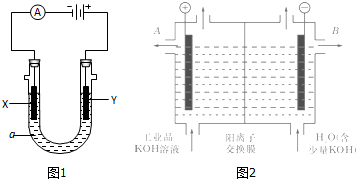
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为2H2O+2e-═2OH-+H2↑.在X极附近观察到的现象是有气泡,溶液变红.
②Y电极上的电极反应式为2Cl--2e-═Cl2↑,检验该电极反应产物的方法是把湿润的淀粉KI试纸放在Y极附近,试纸变蓝,说明Y极产物为Cl2.
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是纯铜,电极反应式是Cu2++2e-═Cu.
②Y电极的材料是粗铜,电极反应式是Cu-2e-═Cu2+.(说明:杂质发生的电极反应不必写出)
(3)工业品氢氧化钾的溶液中含有某些含氧酸杂质,可用离子交换膜法电解提纯.
电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图2所示.
①该电解槽的阳极反应式是4 OH--4 e-=2 H2O+O2↑.
②除去杂质后的氢氧化钾溶液从溶液出口B(填写“A”或“B”)导出.
分析 (1)若X、Y都是惰性电极,a是饱和NaCl溶液,X连接电源负极,为阴极,Y连接电源正极,为阳极.
①阴极发生还原反应,水在阴极放电生成氢气与氢氧根离子,酚酞遇碱变红色;
②阳极发生氧化反应,氯离子在阳极失去多少生成氯气,氯气可以用湿润的淀粉碘化钾试纸检验;
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,阳极应该是粗铜、阴极是纯铜,则X电极是纯铜、Y电极是粗铜,阳极发生氧化反应,Cu失去电子,阴极上发生还原反应,铜离子电子生成Cu;
(3)左室为阳极室,右室为阴极室,阳极发生氧化反应,氢氧根离子放电生成氧气,促进水的电离,阳极室氢离子浓度增大,阴极发生还原反应,H+放电生成氢气,H+浓度减小,促进水的电离,OH-浓度增大,在阴极和阳极之间有阳离子交换膜,只允许阳离子K+和H+通过,这样就在阴极区聚集大量的K+和OH-,从而产生纯的氢氧化钾溶液,所以除去杂质后的氢氧化钾溶液从溶液出口B导出.
解答 解:(1)若X、Y都是惰性电极,a是饱和NaCl溶液,X连接电源负极,为阴极,Y连接电源正极,为阳极.
①阴极发生还原反应,水在阴极放电生成氢气与氢氧根离子,电极反应式为:2H2O+2e-═2OH-+H2↑,反应生成氢气与碱,在X极附近观察到的现象是:有气泡,溶液变红,
故答案为:2H2O+2e-═2OH-+H2↑;有气泡,溶液变红;
②阳极发生氧化反应,氯离子在阳极失去多少生成氯气,电极反应式为:2Cl--2e-═Cl2↑,检验氯气的方法为:把湿润的淀粉KI试纸放在Y极附近,试纸变蓝,说明Y极产物为Cl2,
故答案为:2Cl--2e-═Cl2↑;把湿润的淀粉KI试纸放在Y极附近,试纸变蓝,说明Y极产物为Cl2;
氯气可以用湿润的淀粉碘化钾试纸检验;
(2)电解方法精炼粗铜,电解液a选用CuSO4溶液,粗铜做阳极,精铜做阴极;
①X为阴极,则X电极材料为纯铜,电极反应式为:Cu2++2e-═Cu,
故答案为:纯铜;Cu2++2e-═Cu;
②Y电极为电解池的阳极,所以Y电极的材料是粗铜,电极反应式为:Cu-2e-═Cu2+,
故答案为:粗铜;Cu-2e-═Cu2+;
(3)左室为阳极室,右室为阴极室,阳极发生氧化反应,氢氧根离子放电生成氧气,促进水的电离,阳极室氢离子浓度增大,阴极发生还原反应,H+放电生成氢气,H+浓度减小,促进水的电离,OH-浓度增大,在阴极和阳极之间有阳离子交换膜,只允许阳离子K+和H+通过,这样就在阴极区聚集大量的K+和OH-,从而产生纯的氢氧化钾溶液,所以除去杂质后的氢氧化钾溶液从溶液出口B导出.
①该电解槽的阳极反应式是:4 OH--4 e-=2 H2O+O2↑,故答案为:4 OH--4 e-=2 H2O+O2↑;
②得到的氢气由A口导出,除去杂质后的氢氧化钾溶液从溶液出口B导出,故答案为:B.
点评 本题考查电解原理及应用,关键是判断两极,理解离子放电顺序是解本题关键,难点是电极反应式的书写,注意结合电解质溶液酸碱性书写,难度中等.

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案| A. | AlCl3溶液与过量的浓氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 向Ca(ClO)2溶液通入过量的CO2:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO | |
| C. | FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4 Fe3++2H2O | |
| D. | CuSO4溶液与少量的Ba(OH)2溶液:Ba2+十SO42-═BaSO4↓ |
| A. | D元素处于元素周期表中第二周期VIA族 | |
| B. | 四种元素的原子半径:A<B<C<D | |
| C. | B、D的最高价氧化物具有相似的物理性质和化学性质 | |
| D. | 一定条件下,B单质能置换出D单质,C单质能置换出A单质 |
| A. | 加入过量氨水,有白色沉淀生成,则原溶液一定有Al3+ | |
| B. | 向某溶液中滴加稀盐酸,生成的无色无味气体能使澄清的石灰水变浑浊,则原溶液中一定含有CO32- | |
| C. | 加入盐酸酸化的BaCl2溶液,有白色沉淀生成,则原溶液一定有SO42- | |
| D. | 向Ca(ClO)2溶液通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 |
①
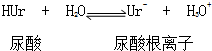 ②Ur-(aq)+Na+(aq)?NaUr(s)
②Ur-(aq)+Na+(aq)?NaUr(s)下列对反应②叙述中正确的是( )
| A. | 反应的△H>0 | B. | 反应的△H=0 | ||
| C. | 升高温度平衡向正反应方向移动 | D. | 降低温度平衡向正反应方向移动 |
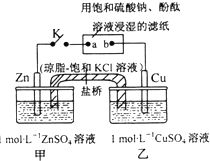
| A. | Zn极上发生还原反应 | |
| B. | 电子沿Zn→a→b→Cu路径流动 | |
| C. | 片刻后,乙池中c(Cu2+)减小,c(SO42-)基本不变,溶液不再保持电中性 | |
| D. | 片刻后可观察到滤纸a点变红色 |
| A. | 加入适量铜粉除去Cu(NO3)2溶液中的Fe(NO3)3杂质 | |
| B. | 在物质提纯操作中不能用乙醇从碘水中萃取碘 | |
| C. | 向Ca(ClO)2溶液中通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 | |
| D. | 向Ca(OH)2溶液中通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失 |
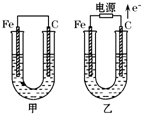 甲、乙两池电极材料都是铁棒与碳棒,两池中均为饱和NaCl溶液,请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒,两池中均为饱和NaCl溶液,请回答下列问题: