题目内容
已知某温度下纯水的pH=6,则该温度下0.05mol/L Ba(OH)2溶液的pH是( )A.13
B.12.7
C.11
D.10.7
【答案】分析:先计算水的离子积常数,再根据水的离子积常数计算氢氧化钡溶液中氢离子浓度,再结合pH=- 计算溶液的pH.
计算溶液的pH.
解答:解:纯水的pH=6,则c(H+)=10-6 mol/L,纯水中,c(H+)=c(OH-)=10-6 mol/L,所以KW=c(H+).c(OH-)=10-12,该温度下0.05mol/L Ba(OH)2溶液中c(OH-)=2×0.05mol/L=0.1mol/L,氢氧化钡溶液中c(H+)= =10-11 mol/L,pH=-
=10-11 mol/L,pH=- =11,
=11,
故选C.
点评:本题考查pH的简单计算,能正确确定该温度下水的离子积常数是解本题关键,注意水的离子积常数的灵活运用.
 计算溶液的pH.
计算溶液的pH.解答:解:纯水的pH=6,则c(H+)=10-6 mol/L,纯水中,c(H+)=c(OH-)=10-6 mol/L,所以KW=c(H+).c(OH-)=10-12,该温度下0.05mol/L Ba(OH)2溶液中c(OH-)=2×0.05mol/L=0.1mol/L,氢氧化钡溶液中c(H+)=
 =10-11 mol/L,pH=-
=10-11 mol/L,pH=- =11,
=11,故选C.
点评:本题考查pH的简单计算,能正确确定该温度下水的离子积常数是解本题关键,注意水的离子积常数的灵活运用.

练习册系列答案
相关题目
对于重水(D2O)可以采用同pH一样的定义来规定pD,pD=-lg[c(D+)],则pOD=-lg[c(OD-)].已知某温度下重水的电离D2O?D++OD-达到平衡时,c(D+)?c(OD-)=1×l0-15,据此,在该温度下,下列叙述正确的是( )
| A、0.1mol DCl溶于D2O配成1L溶液,其pD=1 | B、0.001mol NaOD和重水配成1L溶液,pD=11 | C、纯重水的pD=7 | D、用重水配制FeCl3溶液,溶液中pD>pOD |
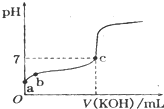 已知某温度下CH3COOH的电离常数k=1.6×10-5,该温度下向20mL 0.01mol?L-1 CH3COOH溶液中逐滴加入0.01mol?L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化),请回答有关问题.
已知某温度下CH3COOH的电离常数k=1.6×10-5,该温度下向20mL 0.01mol?L-1 CH3COOH溶液中逐滴加入0.01mol?L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化),请回答有关问题.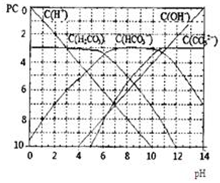 pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中溶质的pC=-lg1×10-3=3.图为H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图.请回答下列问题:
pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中溶质的pC=-lg1×10-3=3.图为H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图.请回答下列问题: