题目内容
18.下列离子方程式书写错误的是( )| A. | 锌跟稀硫酸反应:Zn+2H+=Zn2++H2↑ | |
| B. | 用氯化铁溶液腐蚀铜箔制造印刷电路板:Fe3++Cu=Fe2++Cu2+ | |
| C. | 碳酸钙中加入稀盐酸:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | 单质氯气与水的反应:Cl2+H2O=H++Cl-+HClO |
分析 A.锌与稀硫酸反应生成硫酸锌和氢气;
B.离子方程式两边正电荷不相等,违反了电荷守恒;
C.碳酸钙与稀盐酸反应生成氯化钙、二氧化碳气体和水;
D.氯气与水反应生成氯化氢和次氯酸.
解答 解:A.锌跟稀硫酸反应生成硫酸锌和氢气,反应的离子方程式为:Zn+2H+=Zn2++H2↑,故A正确;
B.用氯化铁溶液腐蚀铜箔制造印刷电路板,正确的离子方程式为:2Fe3++Cu=2Fe2++Cu2+,故B错误;
C.碳酸钙中加入稀盐酸的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O,故C正确;
D.氯气与水的反应生成次氯酸个氯化氢,反应的离子方程式为:Cl2+H2O=H++Cl-+HClO,故D正确;
故选B.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式等,试题培养了学生的灵活应用能力.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
6.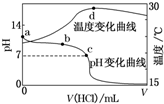 室温下,将1.000mol•L-1盐酸滴入20.00mL1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol•L-1盐酸滴入20.00mL1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
 室温下,将1.000mol•L-1盐酸滴入20.00mL1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol•L-1盐酸滴入20.00mL1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A. | a点由水电离出的c(H+)=1.0×10-14 mol•L-1 | |
| B. | b点:c(NH${\;}_{4}^{+}$)+c(NH3•H2O)=c(Cl-) | |
| C. | c点:c(Cl-)=c(NH${\;}_{4}^{+}$) | |
| D. | d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热 |
13.我国农业因酸雨而造成的损失每年高达15亿多元,为了有效控制酸雨,国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规.
(1)现有雨水样品1份,每隔一段时间测定数据如下:
根据上述材料回答下列问题:(已知Cl2+SO2+2H2O═H2SO4+2HCl)
①酸雨放置时,pH发生变化的主要原因是(用化学方程式表示)2H2SO3+O2=2H2SO4.
②如果将刚取样的上述雨水与少量新鲜自来水混合,pH将变小(填“变大”、“变小”或“不变”).
(2)你认为以下哪些做法是减少酸雨产生的途径①③⑤
①少用煤作燃料 ②把烟囱造高 ③燃料脱硫
④在已酸化的土壤中加石灰 ⑤开发新能源
(3)下列物质不属于“城市空气质量日报”报道的是C
A.二氧化硫B.氮氧化物C.二氧化碳D.可吸入颗粒物.
(1)现有雨水样品1份,每隔一段时间测定数据如下:
| 时间 | 开始 | 8h后 | 16h后 | 24h后 | 32h后 | 40h后 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 |
①酸雨放置时,pH发生变化的主要原因是(用化学方程式表示)2H2SO3+O2=2H2SO4.
②如果将刚取样的上述雨水与少量新鲜自来水混合,pH将变小(填“变大”、“变小”或“不变”).
(2)你认为以下哪些做法是减少酸雨产生的途径①③⑤
①少用煤作燃料 ②把烟囱造高 ③燃料脱硫
④在已酸化的土壤中加石灰 ⑤开发新能源
(3)下列物质不属于“城市空气质量日报”报道的是C
A.二氧化硫B.氮氧化物C.二氧化碳D.可吸入颗粒物.
3.下列现象不能用胶体知识进行解释的是( )
| A. | 向FeCl3饱和溶液中滴加NaOH溶液形成红褐色的分散系 | |
| B. | 一支钢笔使用两种不同牌子的蓝黑墨水,易出现堵塞 | |
| C. | 在河水与海水的交界处,易有三角洲形成 | |
| D. | 水泥厂、冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷 |
7.下列叙述中不正确的是( )
| A. | 从柑桔中可提炼出苧烯(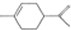 ),其分子式为C10H16,是1,3丁二烯的同系物 ),其分子式为C10H16,是1,3丁二烯的同系物 | |
| B. | 化学式为C4H10O的醇可被氧化成醛的有2种 | |
| C. | 2-氯丁烷(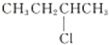 )与NaOH乙醇溶液共热发生消去反应的产物有2种 )与NaOH乙醇溶液共热发生消去反应的产物有2种 | |
| D. | 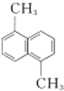 与 与 的一氯代物的数目不相等 的一氯代物的数目不相等 |
8.光束通过下列分散系时,能够发生丁达尔效用的是( )
| A. | 酒精溶液 | B. | 蔗糖溶液 | C. | 色拉油 | D. | Fe(OH)3胶体 |
 实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O
实验室中所用少量氯气是用下列方法制取的,4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O