题目内容
【题目】亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量,某兴趣小组进行下面实验探究,查阅资料知道:
①2NO + Na2O2=2NaNO2
②2NO2+ Na2O2=2NaNO3
③酸性KMnO4溶液可将NO2-氧化为NO3-,MnO4-还原成Mn2+。
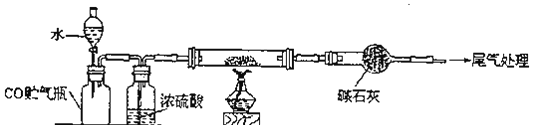
Ⅰ.产品制备与检验:用如下装置制备NaNO2:

(1)写出装置A烧瓶中发生反应的化学方程式并标出电子转移的方向和数目________。
(2)B装置的作用是______________________________。
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为制备纯净NaNO2应在B、C装置间增加一个装置,请在框内画出增加的装置图,并标明盛放的试剂________。

(4)试设计实验检验装置C中NaNO2的存在(写出操作、现象和结论)________。
Ⅱ.含量的测定
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
(5)第一组实验数据出现异常,造成这种异常的原因可能是________(双项选择)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
D.滴定终了俯视读数
(6)根据表中数据,计算所得固体中亚硝酸钠的质量分数____________________。
(结果保留4位有效数字)
【答案】 将NO2转化为NO,同时Cu与稀硝酸反应生成NO或制取NO
将NO2转化为NO,同时Cu与稀硝酸反应生成NO或制取NO  或
或![]() 取少量装置C中产物置于试管中,加入适量蒸馏水溶解,加入稀硫酸酸化,滴加入1~2滴(少量)酸性KMnO4溶液,若溶液紫色褪去,说明C中产物含有NaNO2 A、C 86.25%或0.8625
取少量装置C中产物置于试管中,加入适量蒸馏水溶解,加入稀硫酸酸化,滴加入1~2滴(少量)酸性KMnO4溶液,若溶液紫色褪去,说明C中产物含有NaNO2 A、C 86.25%或0.8625
【解析】
Ⅰ、(1)由装置图可知装置A发生反应为浓硝酸与C的反应,反应中碳元素化合价从0价升高到+4价,失去4个电子,则电子转移可表示为 ;
;
(2)根据实验装置可知,装置C中发生反应:2NO+Na2O2=2NaNO2,则装置B的作用是将NO2转化为NO,同时Cu与稀硝酸反应生成NO(或制取NO);
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,则产生碳酸钠和氢氧化钠的原因是因为NO气体中混有二氧化碳和水蒸气,二者与过氧化钠反应生成碳酸钠和氢氧化钠,故要制备纯净NaNO2应在B、C装置间增加一个装置除去混有的二氧化碳和水蒸气,故应用装有碱石灰的干燥管,装置图为: 或
或![]() ;
;
(4)由题中所给信息③酸性KMnO4溶液可将NO2-氧化为NO3-,MnO4-还原成Mn2+可知欲检验C中NaNO2的存在,需利用酸性高锰酸钾,可设计实验为:取少量装置C中产物置于试管中,加入适量蒸馏水溶解,加入稀硫酸酸化,滴加入1~2滴酸性KMnO4溶液,若溶液紫色褪去,说明C中产物含有NaNO2;
Ⅱ、(5)A、酸式滴定管用蒸馏水洗净后未用标准液润洗,则会导致标准酸性高锰酸钾溶液浓度偏小,则会使所测V(标准)偏大,故A项正确;
B、锥形瓶洗净后未干燥,对实验结果无影响,故B项错误;
C、滴定终了仰视读数,则会导致V(标准)偏大,故C项正确;
D、滴定终了俯视读数,则会导致V(标准)偏小,故D项错误;
本题选AC;
(6)由于第一组数据偏高,应该舍弃;其它三组消耗标准液平均体积为:(20.02+20.00+19.98)mL/3=20.00mL,25mL样品消耗高锰酸钾的物质的量为:0.1000mol/L×0.02L=0.002mol,则250mL样品溶液会消耗高锰酸钾的物质的量为:0.002mol×250Ml/25mL=0.02mol,根据化合价变化可得反应关系式:2MnO4-~5NO2-,则4.000g样品中含有亚硝酸钠的物质的量为:0.02mol×2.5=0.05mol,质量为69g/mol×0.05mol=3.45g,所以反应后的固体中亚硝酸钠的质量分数为:3.45g/4.000g×100%=86.25%。