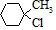题目内容
1.工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼锰.①用铝与软锰矿高温冶炼锰的原理是3MnO2+4Al $\frac{\underline{\;高温\;}}{\;}$3Mn+2Al2O3(用化学方程式来表示).
②MnO2在H2O2分解反应中作催化剂.若将适量MnO2加入酸化的H2O2的溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是MnO2+H2O2+2H+═Mn2++O2↑+2H2O.
分析 ①高温时,铝与二氧化锰发生置换反应生成锰,为铝热反应;
②根据提供的反应物和产物及氧化还原反应可知Mn由+4价变为+2价,氧元素化合价肯定升高.
解答 解:①高温时,铝与二氧化锰发生置换反应生成锰,反应的方程式为3MnO2+4Al$\frac{\underline{\;高温\;}}{\;}$3Mn+2Al2O3,
故答案为:3MnO2+4Al$\frac{\underline{\;高温\;}}{\;}$3Mn+2Al2O3;
②根据氧化还原反应可知Mn由+4价变为+2价,氧化合价肯定升高,所以产物有氧气生成,反应为MnO2+H2O2+2H+═Mn2++O2↑+2H2O,
故答案为:MnO2+H2O2+2H+═Mn2++O2↑+2H2O.
点评 本题考查了化学方程式和离子方程式书写,注意产物判断,掌握基础是解题关键,题目难度不大.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
11.下列叙述正确的是( )
| A. | 短周期元素是指1~20号元素 | |
| B. | 核素的种类和元素的种类一样多 | |
| C. | 元素周期表中共有18列、16个族 | |
| D. | 主族元素的最高正价均等于其族序数 |
12.化学与社会、科学、技术、环境、生活等有密切关系,下列说法正确的是( )
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | 要除去衣服上的顽固污渍,均可将衣服泡在漂白液中 | |
| C. | 纤维素食用在人体内水解为葡萄糖为人体提供能量 | |
| D. | 葡萄中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒 |
9. 硫化锌(ZnS)晶体用作分析试剂、荧光体、光导体材,久置湿空气中易被氧化为ZnSO4.回答下列问题:
硫化锌(ZnS)晶体用作分析试剂、荧光体、光导体材,久置湿空气中易被氧化为ZnSO4.回答下列问题:
(1)写出基态30Zn原子的价电子排布式3d104s2,基态S原子核外未成对电子数为2,有5种能量不同的电子.
(2)ZnSO4中三种元素的电负性由大到小的顺序为O>S>Zn,SO42-的立体构型为正四面体形,它的等电子体是$P{O}_{4}^{3-}$(任写一种),其中SO42-中S的杂化轨道类型为sp3.
(3)Zn(NH3)4]SO4晶体中不存在的微粒间作用力有D、E.
A.离子键 B.共价键 C.配位键 D.范德华力 E.氢键
(4)根据下列锌卤化物的熔点和溶解性,判断ZnF2晶体的类型为离子晶体;分析ZnCl2、ZnBr2、ZnI2熔点依次增大的原因ZnCl2、ZnBr2、ZnI2都是分子晶体,组成与结构相似,随着相对分子质量的增大,范德华力增强,熔沸点升高..
(5)立方ZnS晶体的密度为ρg•cm-3,其晶胞结构如图.Zn2+周围等距离且最近的Zn2+、S2-依次为12、4;ZnS晶胞中的晶胞参数a=$\root{3}{\frac{4×97}{ρ×{N}_{A}}}$cm(列出计算式).
 硫化锌(ZnS)晶体用作分析试剂、荧光体、光导体材,久置湿空气中易被氧化为ZnSO4.回答下列问题:
硫化锌(ZnS)晶体用作分析试剂、荧光体、光导体材,久置湿空气中易被氧化为ZnSO4.回答下列问题:(1)写出基态30Zn原子的价电子排布式3d104s2,基态S原子核外未成对电子数为2,有5种能量不同的电子.
(2)ZnSO4中三种元素的电负性由大到小的顺序为O>S>Zn,SO42-的立体构型为正四面体形,它的等电子体是$P{O}_{4}^{3-}$(任写一种),其中SO42-中S的杂化轨道类型为sp3.
(3)Zn(NH3)4]SO4晶体中不存在的微粒间作用力有D、E.
A.离子键 B.共价键 C.配位键 D.范德华力 E.氢键
(4)根据下列锌卤化物的熔点和溶解性,判断ZnF2晶体的类型为离子晶体;分析ZnCl2、ZnBr2、ZnI2熔点依次增大的原因ZnCl2、ZnBr2、ZnI2都是分子晶体,组成与结构相似,随着相对分子质量的增大,范德华力增强,熔沸点升高..
| ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
| 熔点/℃ | 872 | 275 | 394 | 446 |
| 在乙醇、乙醚中溶解性 | 不溶 | 溶解 | 溶解 | 溶解 |
6.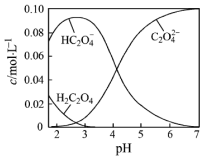 H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定不正确的是( )
H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定不正确的是( )
 H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定不正确的是( )
H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定不正确的是( )| A. | pH=7的溶液中:c(Na+)>2c(C2O42-) | |
| B. | c(Na+)=0.100 mol•L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-) | |
| C. | c(HC2O4-)=c(C2O42-)的溶液中:c(Na+)>0.100 mol•L-1+c(HC2O4-) | |
| D. | c(HC2O4-)=c(C2O42-)的点的坐标为(4.3,0.5),则Na2C2O4的水解平衡常数为Kh=1×10-9.7 |
10.下列事实或现象及结论均正确的是( )
| 选项 | 事实或现象 | 结论 |
| A | 某钾盐中滴加盐酸,产生使澄清石灰水变浑浊的无色气体 | 该钾盐是K2CO3或KHCO3 |
| B | 加热蒸干MgSO4溶液能得到MgSO4固体;加热蒸干MgCl2溶液得不到MgCl2固体 | H2SO4不易挥发,HCl易挥发 |
| C | 常温下,向相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中的铝片先溶解完 | 反应物的浓度越大,反应速率越快 |
| D | NH3沸点低于PH3 | 结构和组成相似的物质,沸点随相对分子质量增大而升高 |
| A. | A | B. | B | C. | C | D. | D |


 .
.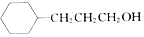 ,流程如下
,流程如下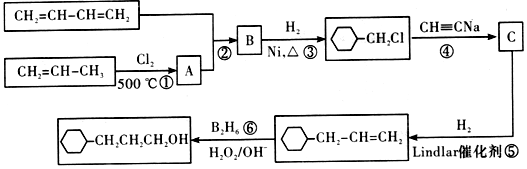
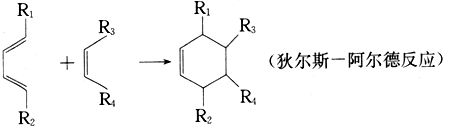
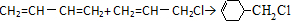
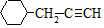
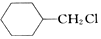 含有六元环且核磁共振氢谱有4组峰值的同分异构体的结构筒式
含有六元环且核磁共振氢谱有4组峰值的同分异构体的结构筒式