题目内容
15.已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )| A. | X与Y形成化合物时,X可以显负价,Y显正价 | |
| B. | 在元素同周期表中X可能位于Y的右面 | |
| C. | 最高价含氧酸的酸性:X对应的酸性弱于Y对应的酸性 | |
| D. | Y的气态氢化物的稳定性小于X的气态氢化物的稳定性 |
分析 X、Y元素同周期,且电负性X>Y,则非金属性X>Y,X一定在Y的右面,结合元素周期律来解答.
解答 解:A.电负性X>Y,则X与Y形成化合物时,X可以显负价,Y显正价,故A正确;
B.电负性X>Y,则非金属性X>Y,X一定在Y的右面,故B正确;
C.非金属性X>Y,但X可能为F,不存在最高价含氧酸,故C错误;
D.非金属性X>Y,Y的气态氢化物的稳定性小于X的气态氢化物的稳定性,故D正确;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、元素的性质为解答的关键,侧重分析与应用能力的考查,注意电负性与非金属性的关系及X可能为F,题目难度不大.

练习册系列答案
相关题目
6.既能溶于盐酸,又能溶于NaOH溶液的是( )
| A. | Si | B. | Mg | C. | MgO | D. | Al2O3 |
3.在相同条件下完全燃烧甲烷、丙烷、乙烯.如使产生的水蒸气(相同状况)的体积相等,则所需三种气体的质量比是( )
| A. | 1:2:1 | B. | 2:1:2 | C. | 4:22:7 | D. | 8:11:14 |
10.在2A+B?3C+4D中,表示该反应速率最快的是( )
| A. | υ(A)=0.5mol•L-1•S-1 | B. | υ(B)=0.3 mol•L-1•S-1 | ||
| C. | υ(C)=0.8mol•L-1•S-1 | D. | υ(D)=6 mol•L-1•min-1 |
20.要鉴别无瓶签的四氯化碳、苯、酒精、乙酸四瓶液体,下列一种试剂就可行的是( )
| A. | 水 | B. | 石蕊试液 | C. | 氢氧化钠溶液 | D. | 溴水 |
7.将0.1mol/L的NaHC2O4溶液与0.1mol/L的NaOH溶液等体积混合后,关于该混合溶液说法不正确的是( )
| A. | 该混合溶液中有:c(Na+)+c(H+)=c(HC2O4-)+c(OH-)+2 c(C2O42-) | |
| B. | 该混合溶液中有:c( Na+)=2[c(HC2O4-)+c(H2C2O4)+c(C2O42-)] | |
| C. | 该混合溶液中有:c(OH-)-c(H+)=c(HC2O4-)+2 c(H2C2O4) | |
| D. | 该混合溶液中有:c(Na+)>c(C2O42-)>c(HC2O4-)>c(OH-)>c(H+) |
4.单斜硫和正交硫是硫的两种同素异形体.
已知:①S(s,单斜)+O2(g)═SO2(g)△H1=-297.16kJ•mol-1
②S(s,正交)+O2(g)═SO2(g)△H2=-296.83kJ•mol-1
下列说法正确的是( )
已知:①S(s,单斜)+O2(g)═SO2(g)△H1=-297.16kJ•mol-1
②S(s,正交)+O2(g)═SO2(g)△H2=-296.83kJ•mol-1
下列说法正确的是( )
| A. | S(s,单斜)═S(s,正交)△H3=+0.33 kJ•mol-1 | |
| B. | 正交硫比单斜硫稳定 | |
| C. | 相同物质的量的正交硫比单斜硫所含有的能量高 | |
| D. | ①式表示断裂1 mol O2中的共价键所吸收的能量比形成1 mol SO2中的共价键所放出的能量多297.16 kJ |
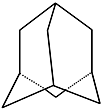 金刚烷的结构如图所示,它可看作是由四个等同的六元环组成的空间构型.
金刚烷的结构如图所示,它可看作是由四个等同的六元环组成的空间构型. 将等径圆球在二维空间里进行排列,可形成密置层和非密置层,在图1所示的半径相等的圆球的排列中,A属于非密置层,配位数是4.
将等径圆球在二维空间里进行排列,可形成密置层和非密置层,在图1所示的半径相等的圆球的排列中,A属于非密置层,配位数是4.