题目内容
向浓度为1mol/L的FeCl2溶液中通入足量的Cl2.下列有关溶液中离子浓度大小关系一定错误的是( )
分析:向浓度为1mol/L的FeCl2溶液中通入足量的Cl2,氯气有强氧化性,亚铁离子有还原性,二者能发生氧化还原反应,离子反应方程式为:2Fe2++Cl2=2Fe3++2Cl-,
A.氯化亚铁是强酸弱碱盐,亚铁离子易水解而使其溶液呈酸性,再结合电荷守恒判断离子浓度大小;
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
C.氯化铁是强酸弱碱盐,铁离子易水解而使其溶液呈酸性,再结合电荷守恒判断;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断.
A.氯化亚铁是强酸弱碱盐,亚铁离子易水解而使其溶液呈酸性,再结合电荷守恒判断离子浓度大小;
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
C.氯化铁是强酸弱碱盐,铁离子易水解而使其溶液呈酸性,再结合电荷守恒判断;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断.
解答:解:向浓度为1mol/L的FeCl2溶液中通入足量的Cl2,氯气有强氧化性,亚铁离子有还原性,二者能发生氧化还原反应,离子反应方程式为:2Fe2++Cl2=2Fe3++2Cl-,
A.氯化亚铁是强酸弱碱盐,亚铁离子易水解而使其溶液呈酸性,所以c(H+)>c(OH-),溶液中存在电荷守恒,根据电荷守恒得2c(Fe2+)+c(H+)=c(Cl-)+c(OH-),所以c(Cl-)>c(Fe2+),盐溶液水解较微弱,所以c(Fe2+)>c(H+),则离子浓度大小顺序是c(Cl-)>c(Fe2+)>c(H+)>c(OH-),故A正确;
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒得2c(Fe2+)+c(H+)=c(Cl-)+c(OH-),故B正确;
C.氯化铁是强酸弱碱盐,铁离子易水解而使其溶液呈酸性,则c(H+)>c(OH-),溶液中存在电荷守恒,根据电荷守恒得3c(Fe3+)+c(H+)=c(Cl-)+c(OH-),则c(Cl-)>c(Fe3+),故C错误;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒得3c(Fe3+)+c(H+)=c(Cl-)+c(OH-),故D正确;
故选C.
A.氯化亚铁是强酸弱碱盐,亚铁离子易水解而使其溶液呈酸性,所以c(H+)>c(OH-),溶液中存在电荷守恒,根据电荷守恒得2c(Fe2+)+c(H+)=c(Cl-)+c(OH-),所以c(Cl-)>c(Fe2+),盐溶液水解较微弱,所以c(Fe2+)>c(H+),则离子浓度大小顺序是c(Cl-)>c(Fe2+)>c(H+)>c(OH-),故A正确;
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒得2c(Fe2+)+c(H+)=c(Cl-)+c(OH-),故B正确;
C.氯化铁是强酸弱碱盐,铁离子易水解而使其溶液呈酸性,则c(H+)>c(OH-),溶液中存在电荷守恒,根据电荷守恒得3c(Fe3+)+c(H+)=c(Cl-)+c(OH-),则c(Cl-)>c(Fe3+),故C错误;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒得3c(Fe3+)+c(H+)=c(Cl-)+c(OH-),故D正确;
故选C.
点评:本题考查了离子浓度大小的判断及氧化还原反应,根据物质之间发生的反应、盐类水解、电荷守恒来分析解答即可,难度中等.

练习册系列答案
相关题目
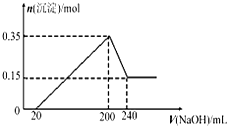 将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示,则下列说法不正确的是( )
将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示,则下列说法不正确的是( )| A、Mg和Al的总质量为9g | B、生成的H2在标准状况下的体积为11.2L | C、NaOH溶液的物质的量浓度为5mol/L | D、硫酸的物质的量浓度为1mol/L |