题目内容
18.用锌片与1mol•L-1稀盐酸反应制取氢气,下列措施不能使反应速率增大的是( )| A. | 改用锌粉 | B. | 滴入几滴硫酸铜溶液 | ||
| C. | 加入少量1mol•L-1稀硫酸 | D. | 加入少量NaCl溶液 |
分析 根据影响化学反应速率的因素分析,若增大反应速率,可以升高温度、增大锌的表面积、增大氢离子浓度等,而加入少量氯化钠溶液,导致原溶液中氢离子浓度减小,反应速率减小,据此进行解答.
解答 解:A.锌片改为锌粉,增大了锌的接触面积,可以加快反应速率,故A不选;
B.锌与滴入几滴硫酸铜溶液反应生成少量的铜,构成锌铜原电池加快化学反应速率,故B不选;
C.加入1mol/L的稀硫酸,增大了溶液中氢离子浓度,从而加快了反应速率,故C不选;
D.加入少量氯化钠溶液,钠离子和氯离子不需要锌与氢离子的反应,而原溶液中氢离子浓度减小,导致反应速率减小,故D选;
故选D.
点评 本题考查了化学反应速率及其影响因素,题目难度不大,明确影响化学反应速率的因素为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
8.类推的思维方法在化学学习和研究中有时会产生错误的结论,因此类比推出的结论最终要经过实践的检验才能决定其正确与否.下列类推结论中正确的是( )
| A. | Cu与Cl2直接化合生成CuCl2;Cu与S直接化合也能得到CuS | |
| B. | Fe3O4可写成FeO•Fe2O3;Pb3O4也可写成PbO•Pb2O3 | |
| C. | Mg失火不能用CO2灭火;Na失火也不能用CO2灭火 | |
| D. | 工业上电解熔融MgCl2制取金属镁;也用电解熔融AlCl3的方法制取金属铝 |
9.下列说法错误的是( )


| A. | 酒精可以和水以任意比例互溶,与氢键有关 | |
| B. | 邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点,与氢键有关 | |
| C. | 无机含氧酸的化学式可以用XOn(OH)m表示,n值越大,则该酸的酸性就越强.则可推知,硫酸酸性强于磷酸 | |
| D. | 如图该分子中没有手性碳原子 |
6.对于反应2Na2O2+2H2O═4NaOH+O2↑,该反应不属于( )
| A. | 置换反应 | B. | 离子反应 | C. | 氧化还原反应 | D. | 放热反应 |
13.Diels-Alder反应为共轭双烯与含有烯键或炔键的化合物相互作用生成六元环状化合物的反应,最简单的反应是 .如果要合成
.如果要合成 ,所用的原始原料可以是( )
,所用的原始原料可以是( )
 .如果要合成
.如果要合成 ,所用的原始原料可以是( )
,所用的原始原料可以是( )| A. | 2,3-二甲基-1,3-丁二烯和乙烯 | B. | 2,3-二甲基-1,3-丁二烯和乙炔 | ||
| C. | 1,3-丁二烯和2-丁炔 | D. | 1,3-丁二烯和2-丁烯 |
3.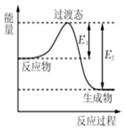 如图为1molSO2Cl2(g)和1molSCl2(g)反应生成SOCl2(g)能量变化的示意图,已知E1=xkJ/mol,E2=ykJ/mol,下列有关说法正确的是( )
如图为1molSO2Cl2(g)和1molSCl2(g)反应生成SOCl2(g)能量变化的示意图,已知E1=xkJ/mol,E2=ykJ/mol,下列有关说法正确的是( )
 如图为1molSO2Cl2(g)和1molSCl2(g)反应生成SOCl2(g)能量变化的示意图,已知E1=xkJ/mol,E2=ykJ/mol,下列有关说法正确的是( )
如图为1molSO2Cl2(g)和1molSCl2(g)反应生成SOCl2(g)能量变化的示意图,已知E1=xkJ/mol,E2=ykJ/mol,下列有关说法正确的是( )| A. | 若在反应体系中加入催化剂,E1不变 | |
| B. | 活化能的大小决定了反应热的大小 | |
| C. | 该反应的活化能等于ykJ/mol | |
| D. | 1molSO2Cl2(g)和1molSCl2(g)反应生成SOCl2(g)的△H=(x-y)kJ/mol |
10.2016年诺贝尔化学奖授予在“分子机器设计和合成”领域有突出成就的三位科学家,有机物甲和乙为“分子马达”的关键组件.下列说法正确的是( )


| A. | 甲是苯的同系物,乙不是苯的同系物,甲乙瓦为同分异构体 | |
| B. | 甲、乙均能发生取代反应和加成反应 | |
| C. | 甲的一氯代物有2种,乙的一氯代物有7种(不考虑顺反异构) | |
| D. | 甲分子中所有原了可能在同一平面上,乙分子中所有原了一定在同一平面上 |
8.T℃时,在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g).反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示.则下列结论不正确的是( )
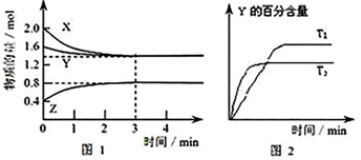

| A. | 容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) | |
| B. | 反应进行的前3 min内,用X表示的反应速率 v(X)=0.3mol/(L•min) | |
| C. | 据图2可知,相对于T1,温度为T2时更快达到“拐点”,说明T2时化学反应速率更快,可确定温度T2高于T1 | |
| D. | 若改变反应条件,使反应进程如图3所示,则改变的条件可能是使用了催化剂 |