题目内容
14.O2和O3是氧元素的两种单质,根据其分子式完成下列各题:(1)等质量的O2和O3所含分子个数比为3:2,原子个数比为1:1.
(2)等温等压下,等体积的O2和O3所含原子个数比为2:3,质量之比为2:3.
(3)20g NaOH溶解在90g水中,才能使每十个水分子中溶有一个钠离子.
(4)常温常压下,14g由N2和CO组成的混合气体中含有
 的原子数目为NA.
的原子数目为NA.
分析 (1)等质量时,物质的分子个数与摩尔质量成反比;氧气和臭氧均由氧原子构成;
(2)同温同压下,气体摩尔体积相同,故等体积的气体的物质的量相等,而O2和O3所含的原子个数之比为2:3;当物质的量相等时,物质的质量之比等于摩尔质量之比;
(3)根据n=$\frac{m}{M}$计算水的物质的量,进而计算氢氧化钠的物质的量,根据m=nM计算氢氧化钠的质量;
(4)N2和CO的摩尔质量均为28g/mol,且氮气和CO均为双原子分子.
解答 解:(1)等质量时,物质的分子个数与摩尔质量成反比,故等质量的O2和O3的分子个数之比等于48:32=3:2;而氧气和臭氧均由氧原子构成,故等质量的氧气和臭氧中氧原子的个数相等,即1:1,故答案为:3:2;1:1;
(2)同温同压下,气体摩尔体积相同,故等体积的氧气和臭氧的物质的量相等,而O2和O3所含的原子个数之比为2:3,故等物质的量的氧气和臭氧中氧原子的个数之比为2:3;当物质的量相等时,物质的质量之比等于摩尔质量之比,故两者的质量之比为32:48=2:3,故答案为:2:3;2:3;
(3)90g 水的物质的量=$\frac{90g}{18g/mol}$=5mol,要使每10个水分子中溶有一个钠离子,则:n(NaOH)=$\frac{5mol}{10}$=0.5mol,故m(NaOH)=0.5mol×40g/mol=20g,
故答案为:20;
(4)N2和CO的摩尔质量均为28g/mol,故14g混合物的物质的量为0.5mol,而且氮气和CO均为双原子分子,故0.5mol混合气体中含1mol原子即NA个,故答案:NA.
点评 本题考查了物质的量和阿伏伽德罗常数的有关计算,熟练掌握公式的运用和物质的结构是解题的关键,难度不大.

练习册系列答案
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案
相关题目
5.下列陈述Ⅰ、Ⅱ正确并有因果关系的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 氢氟酸具有酸性 | 氢氟酸可用于雕刻玻璃 |
| B | 氯水显酸性 | 可用pH试纸测氯水的pH |
| C | NH3极易溶于水 | NH3可用作制冷剂 |
| D | ClO2具有强氧化性 | ClO2可用于自来水的杀菌消毒 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
9.制取氯水时,下列制备方法最合理的是( )
| A. | 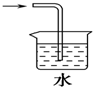 | B. | 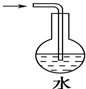 | ||
| C. | 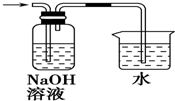 | D. |  |
19.除去表中物质中含有杂质,所选试剂错误的是( )
| 选项 | 物质 | 杂质 | 试剂及操作 |
| A | 氢氧化钠 | 硫酸钠 | 加入适量氢氧化钙,过滤 |
| B | 生石灰 | 碳酸钙 | 高温锻烧 |
| C | 二氧化碳 | 一氧化碳 | 通过有足量灼烧氧化铁的玻璃管 |
| D | 氧化铜粉末 | 木炭粉 | 隔绝空气加强热 |
| A. | A | B. | B | C. | C | D. | D |
6.下列长式元素周期表族序数正确的是( )
| A. | 第三列为ⅠB | B. | 第十三列为ⅢA | C. | 第十六列为ⅣA | D. | 第十八列为0A |
3.化学与生活密切相关,下列有关说法正确的是( )
| A. | 油脂、乙酸乙酯都属于酯类,水解后都会生成乙醇 | |
| B. | 人的皮肤在强紫外线的照射下将会失去生理活性 | |
| C. | 棉花和蚕丝的主要成分都是纤维素 | |
| D. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |
4.某物质属于电解质,则该物质不可能属于( )
| A. | 金属氧化物 | B. | 强碱 | C. | 单质 | D. | 正盐 |