题目内容
4.下表为周期表的一部分,其中的编号代表对应不同的元素.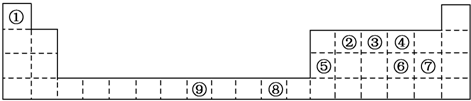
请回答下列问题.
(1)表中属于d区的元素是⑨(填编号);元素⑧的原子外围电子排布式是3d104s1.
(2)③和⑦形成的常见化合物的晶体类型是分子晶体;②③④的电负性:O>N>C(用元素符号表示).判断依据是同周期元素从左到右的非金属性逐渐增强,气态氢化物最稳定的是H2O(写化学式);
(3)某元素的特征电子排布式(价电子排布式)为nsnnpn+1,该元素为周期表中的③(填编号);该元素与元素①形成的化合物X极易溶于水的原因是氨气和水都是极性分子,氨气和水分子间可以形成分子间氢键.
(4)②⑥形成化合物的化学式为CS2,其熔点比金刚石的低(填“高”或“低”).
(5)⑤的氧化物与⑥的最高价氧化物的水化物反应的方程式为Al2O3+3H2SO4═Al2(SO4)3+3H2O.
分析 由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Al、⑥为S、⑦为Cl、⑧为Cu、⑨为Fe,
(1)d区元素包含周期表中3-10列元素;Cu的原子序数为29;
(2)③和⑦形成的常见化合物为NCl3,由分子构成;非金属性越强,对应电负性越大、气态氢化物越稳定;
(3)元素的特征电子排布式(价电子排布式)为nsnnpn+1,n只能为2;
(4)②⑥形成化合物为CS2,为分子晶体,而金刚石为原子晶体,原子晶格熔点高;
(5)氧化铝与硫酸反应生成硫酸铝和水.
解答 解:由元素在周期表中位置,可知可知①为H、②为C、③为N、④为O、⑤为Al、⑥为S、⑦为Cl、⑧为Cu、⑨为Fe,
(1)d区元素包含周期表中3-10列元素,上述元素中只有⑨号元素属于d区,元素⑧为Cu,其外围电子排布式为3d104s1,故答案为:⑨;3d104s1;
(2)N和Cl形成的常见化合物是NCl3,由分子构成,属于分子晶体,元素的非金属性越强,其电负性越大,气态氢化物越稳定,由于非金属性O>N>C,故电负性:O>N>C,气态氢化物最稳定的是H2O,
故答案为:分子晶体;O>N>C;同周期元素从左到右的非金属性逐渐增强;H2O;
(3)某元素的特征电子排布式(价电子排布式)为nsnnpn+1,s上最多排布2个电子,故n=2,该元素是N,N为周期表中的③,N元素与元素H形成的化合物X为氨气,由于氨气和水都是极性分子,氨气和水分子间可以形成分子间氢键,
故答案为:③;氨气和水都是极性分子,氨气和水分子间可以形成分子间氢键;
(4)②⑥形成化合物为CS2,为分子晶体,而金刚石为原子晶体,原子晶格熔点高,则其熔点比金刚石的低,故答案为:CS2;低;
(5)氧化铝与硫酸反应的方程式为Al2O3+3H2SO4═Al2(SO4)3+3H2O,故答案为:Al2O3+3H2SO4═Al2(SO4)3+3H2O.
点评 本题考查位置、结构、性质的应用,为高频考点,涉及元素周期表中元素的分区、元素周期表中元素的位置、晶体类型、化学反应等,综合性较强,题目难度较大.

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案(1)分子数(2)体积(3)密度(4)原子数.
| A. | 仅(1)(2) | B. | (1)(2)(3) | C. | (1)(2)(3)(4) | D. | 以上都不相同 |
| A. | 在原电池的负极和电解池的阴极上都发生失电子的氧化反应 | |
| B. | 电解是把电能转化成化学能 | |
| C. | 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 mol NaOH | |
| D. | 钢铁发生电化学腐蚀时生成Fe3O4 |
| A. | 苯中溶有苯酚(浓溴水,过滤) | B. | 甲烷中含有乙烯(溴水,洗气) | ||
| C. | 乙醇中的乙酸(NaOH溶液,分液) | D. | 乙醇中含有水(金属钠,蒸馏) |
①熔点低;②硬度大;③密度小;④导电性强;⑤延展性好;⑥耐腐蚀.
| A. | ①②③ | B. | ②③④ | C. | ②③⑥ | D. | ②⑤⑥ |
| A. | CH3OH | B. |  | ||
| C. |  | D. |  |
| A. | 碘水 | B. | Na2CO3溶液 | C. | FeCl2溶液 | D. | 银氨溶液 |
| A. |  除去酒精中的水 | B. |  验证乙醇的氧化性 | ||
| C. |  制备溴苯 | D. |  分离CCl4和碘单质 |