题目内容
6.下列叙述正确的是( )| A. | 二氧化硅是酸性氧化物,不与任何酸反应 | |
| B. | 因为CO2通入水玻璃中可制得硅酸,说明碳酸的酸性比硅酸酸性强 | |
| C. | 水玻璃是一种矿物胶,黏性强,性质稳定,在空气中不易变质 | |
| D. | 石英玻璃是纯净物 |
分析 A、二氧化硅和氢氟酸反应;
B、复分解反应中强酸可以制备弱酸;
C、水玻璃是硅酸钠的水溶液在空气中易和二氧化碳反应生成硅酸;
D、石英的主要成分是二氧化硅,不是纯净物.
解答 解:A、二氧化硅是酸性氧化物,能和氢氟酸反应,故A错误;
B、复分解反应中强酸可以制备弱酸,CO2通入水玻璃中可制得硅酸,说明碳酸的酸性比硅酸酸性强,非金属元素最高价含氧酸酸性大,非金属性强,故B正确;
C、水玻璃是硅酸钠的水溶液在空气中易和二氧化碳反应生成硅酸变质,故C错误;
D、石英的主要成分是二氧化硅,不是纯净物,故D错误;
故选B.
点评 本题考查了硅、二氧化硅性质的分析判断,掌握物质性质是解题关键,题目较简单.

练习册系列答案
相关题目
16.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 每摩尔甲基中含10NA个电子 | |
| B. | 标准状况下2.24 L乙醇与足量Na反应生成H2分子数0.05NA | |
| C. | 14 g乙烯含有H原子数为2NA | |
| D. | 78 g苯中含有的碳碳双键的数目为3NA |
17.X、Y、Z、W为四种短周期元素,它们的性质、原子结构等信息如表:
回答下列问题:
(1)W在元素周期表中的位置是第三周期第ⅦA 族.X、Y、W三种元素的简单离子半径大小是S2->Cl->Na+;(用离子符号表示)
(2)Y单质在氧气中燃烧的产物的电子式为 .用电子式表示元素X与Y形成化合物的过程
.用电子式表示元素X与Y形成化合物的过程 ;
;
(3)Z的气态氢化物的沸点反常,原因是NH3分子间存在氢键.元素W与元素X相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是②④;
①常温下W的单质和X的单质状态不同
②W的氢化物比X的氢化物稳定
③一定条件下W和X的单质都能与氢氧化钠溶液反应
④W的单质可以和X的氢化物水溶液反应置换出X
(4)Z2在一定条件下能和氢气反应生成气态氢化物,已知破坏1mol氢气中的化学键消耗的能量为Q1kJ,破坏1molZ2中的化学键消耗的能量为Q2kJ,形成1molZ-H化学键释放的能量为O3kJ,则上述反应放出的能量可表示为6Q3-3Q1-Q2kJ.
| X | 原子M层上的电子数是原子核外电子层数的2倍 |
| Y | 短周期中原子半径最大的元素 |
| Z | 元素的单质为双原子分子,Z的氢化物水溶液呈碱性 |
| W | 元素最高正价是+7价 |
(1)W在元素周期表中的位置是第三周期第ⅦA 族.X、Y、W三种元素的简单离子半径大小是S2->Cl->Na+;(用离子符号表示)
(2)Y单质在氧气中燃烧的产物的电子式为
 .用电子式表示元素X与Y形成化合物的过程
.用电子式表示元素X与Y形成化合物的过程 ;
;(3)Z的气态氢化物的沸点反常,原因是NH3分子间存在氢键.元素W与元素X相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是②④;
①常温下W的单质和X的单质状态不同
②W的氢化物比X的氢化物稳定
③一定条件下W和X的单质都能与氢氧化钠溶液反应
④W的单质可以和X的氢化物水溶液反应置换出X
(4)Z2在一定条件下能和氢气反应生成气态氢化物,已知破坏1mol氢气中的化学键消耗的能量为Q1kJ,破坏1molZ2中的化学键消耗的能量为Q2kJ,形成1molZ-H化学键释放的能量为O3kJ,则上述反应放出的能量可表示为6Q3-3Q1-Q2kJ.
14.将ag水煤气(成分为CO和H2)充分燃烧,将燃烧生成的气体(150℃)通过盛有过量的Na2O2的干燥管(反应气体无损失),充分反应后干燥管增重bg,则a和b的关系为( )
| A. | a=b | B. | a>b | C. | a<b | D. | 无法比较 |
18.下列叙述正确的是( )
| A. | 室温下pH=7的CH3COOH与CH3COONa的混合液中离子的浓度大小顺序为:c(Na+)>c(CHCOO-)>c(H+)=c(OH-) | |
| B. | 0.1mol/LKHS的溶液中,c(K+)═2c(S2-)+c(HS-)+c(H2S) | |
| C. | 25℃时,pH均为12的NaOH溶液和Na2CO3溶液中由水电离出的c(OH-),前者小于后者 | |
| D. | 中和pH和体积相同的盐酸与醋酸溶液,消耗NaOH的物质的量相等 |

 黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其燃烧产物为SO2和Fe2O3.
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其燃烧产物为SO2和Fe2O3.
 ;
; 、
、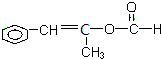 、
、 ;
; +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +NaCl+2H2O.
+NaCl+2H2O.