题目内容
在0.2L溶液里含有0.2mol氯化钠和0.2mol氯化镁,则此溶液中氯离子的物质的量浓度(单位为mol/L)为( )
| A、3 | B、0.5 | C、2.5 | D、1 |
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:溶液中n(Cl-)=n(NaCl)+2n(MgCl2),再根据c=
计算溶液中氯离子浓度.
| n |
| V |
解答:
解:溶液中n(Cl-)=n(NaCl)+2n(MgCl2)=0.2mol+2×0.2mol=0.6mol,
故溶液中氯离子浓度=
=3mol/L,
故选A.
故溶液中氯离子浓度=
| 0.6mol |
| 0.2L |
故选A.
点评:本题考查溶液物质的量浓度计算,比较基础,关键是计算氯离子物质的量,注意对公式的理解.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列物质间的转化可由一步反应完成的是( )
| A、SiO2→H2SiO3 |
| B、Cu(OH)2→Fe(OH)2 |
| C、CaCO3→Na2CO3 |
| D、Cu→Cu(NO3)2 |
下列因果关系叙述正确的是( )
| A、SO2具有漂白性,故可使酸性KMnO4溶液褪色 |
| B、浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色 |
| C、Na的金属性比Mg强,故可用Na与MgCl2溶液反应制取Mg |
| D、Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中Fe也显+3价 |
下列关于油脂的叙述不正确的是( )
| A、油脂属于酯类 |
| B、油脂是高级脂肪酸甘油酯 |
| C、油脂没有固定的熔、沸点 |
| D、油脂都不能使溴水或高锰酸钾溶液褪色 |
下列运用元素周期律推断元素性质,有明显错误的是( )
| A、硒化氢(H2Se)是无色、有毒,比H2S稳定的气体 |
| B、氢氧化铍[Be(OH)2]的碱性比氢氧化镁弱 |
| C、单质砹(At)为有色固体,AgAt不溶于水也不溶于稀酸 |
| D、硫酸锶(SrSO4)是难溶于水的白色固体 |
下列从海水中提取镁的工艺流程中,你认为最合理的是( )
A、海水
| ||||||
B、海水
| ||||||
C、海水
| ||||||
D、海水
|
药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
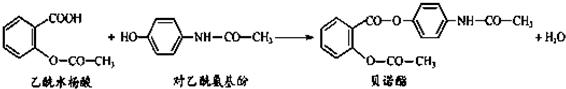
下列有关叙述正确的是( )

下列有关叙述正确的是( )
| A、贝诺酯分子中有三种含氧官能团 |
| B、对乙酰氨基酚核磁共振氢谱中共有四个峰 |
| C、乙酰水杨酸和对乙酰氨基酚均能与Na2CO3 溶液反应 |
| D、贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 |
下列说法中正确的是( )
| A、胶体带电荷,而溶液呈电中性 |
| B、胶体区别与其他分散系的本质特征是分散质粒子的大小 |
| C、某元素从化合态变为游离态时,该元素一定被还原 |
| D、醋酸、纯碱、石灰石、氨水分别属于酸、碱、盐和电解质 |