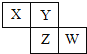��Ŀ����
����Ŀ��ʯ���ǹ�ҵ��ѪҺ��ͨ�������Եõ��ܶ���Ҫ�Ļ�����Ʒ��
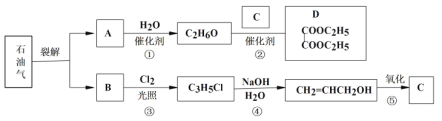
��֪��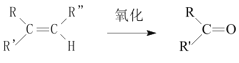 +
+
��1��B��AΪͬϵ�B�Ľṹ��ʽΪ____���京�еĹ���������Ϊ____��
��2����Ӧ�ٵĻ�ѧ����ʽΪ___���䷴Ӧ����Ϊ____��
��3��д������C3H5Cl�к��е�Clԭ�ӵķ���____��
��4��C�Ľṹ��ʽΪ___��
��5����Ӧ�ܵĻ�ѧ����ʽΪ_____��
��6�����һ������ϩΪԭ���Ʊ�D�ĺϳ�·�ߣ�������ԭ����ѡ����___
�ϳ�·������ͼʾ�����£�CH3CH2OH![]() CH2=CH2
CH2=CH2![]() BrH2C-CH2Br��
BrH2C-CH2Br��
���𰸡�CH2=CHCH3 ̼̼˫�� CH2=CH2+H2O![]() CH3CH2OH �ӳɷ�Ӧ ȡ�����ȼ���NaOH��Һ���ȣ���ȴ�����ϡ�����ữ���ټ���AgNO3��Һ���а�ɫ������������Clԭ�ӣ����� HCOO-COOH CH2=CHCH2Cl+NaOH
CH3CH2OH �ӳɷ�Ӧ ȡ�����ȼ���NaOH��Һ���ȣ���ȴ�����ϡ�����ữ���ټ���AgNO3��Һ���а�ɫ������������Clԭ�ӣ����� HCOO-COOH CH2=CHCH2Cl+NaOH![]() CH2=CHCH2OH+NaCl CH2=CH2
CH2=CHCH2OH+NaCl CH2=CH2![]() CH3CH2OH
CH3CH2OH
CH2=CH2![]() BrCH2-CH2Br
BrCH2-CH2Br![]() HOCH2-CH2OH
HOCH2-CH2OH![]()
![]()

��������
������ͼ��֪AΪ��ϩ����ˮ�ӳɵ��Ҵ�����C��Ӧ����D��CΪ HCOO-COOH��
BΪCH2=CHCH3������������ȡ����Ӧ��CH2=CHCH2Cl���ٷ���CH2=CHCH2Cl+NaOH![]() CH2=CHCH2OH+NaCl����CH2=CHCH2OH��������Ϣ��������C��
CH2=CHCH2OH+NaCl����CH2=CHCH2OH��������Ϣ��������C��
��1��AΪ��ϩ��B��AΪͬϵ���3��̼������B�Ľṹ��ʽΪCH2=CHCH3���京�еĹ���������Ϊ̼̼˫����
��2��CH2=CH2��H2O�����ӳɷ�Ӧ����Ӧ�ٵĻ�ѧ����ʽΪ CH2=CH2+H2O![]() CH3CH2OH���䷴Ӧ����Ϊ�ӳɷ�Ӧ��
CH3CH2OH���䷴Ӧ����Ϊ�ӳɷ�Ӧ��
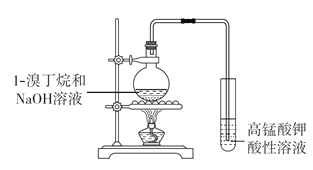
��3��C3H5Cl�ǹ��ۻ������ˮ���ѵ��룬Ҫ��ˮ����������ӣ�����C3H5Cl�к��е�Clԭ�ӵķ�����ȡ�����ȼ���NaOH��Һ���ȣ���ȴ�����ϡ�����ữ���ټ���AgNO3��Һ���а�ɫ������������Clԭ�ӣ�������
��4��AΪ��ϩ����ˮ�ӳɵ��Ҵ�����C��Ӧ����D��CΪ HCOO-COOH��
��5��±�����ڼ��������·���ˮ�ⷴӦ���ܵĻ�ѧ����ʽΪCH2=CHCH2Cl+NaOH![]() CH2=CHCH2OH+NaCl ��
CH2=CHCH2OH+NaCl ��
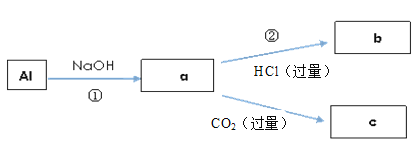
��6����ϩ����ӳɣ���BrCH2-CH2Br���ڼ���������ˮ���HOCH2-CH2OH�����������Ҷ��ᣬ���������Ӧ��D������ϩΪԭ���Ʊ�D�ĺϳ�·��
CH2=CH2![]() CH3CH2OH
CH3CH2OH
CH2=CH2![]() BrCH2-CH2Br
BrCH2-CH2Br![]() HOCH2-CH2OH
HOCH2-CH2OH![]()
![]()
 ��
��

����Ŀ����CH4��H2OΪԭ�ϣ�ͨ�����з�Ӧ���Ʊ��״���
I��CH4(g) + H2O(g) ![]() CO(g) + 3H2(g) ��H��+206.0kJ��mol��1
CO(g) + 3H2(g) ��H��+206.0kJ��mol��1
II��CO(g) + 2H2(g) ![]() CH3OH(g) ��H����129.0kJ��mol��1
CH3OH(g) ��H����129.0kJ��mol��1
��1��һ���¶��£����ݻ�2L�ҹ̶��������ܱ������У������·�ʽ���뷴Ӧ�����ӦI��һ��ʱ���ﵽƽ�⡣
�� �� | �� | �� |
��Ӧ��Ͷ���� | 1molCH4��1molH2O | a molCH4��a molH2O��b molCO��c molH2 |
���ⶨ����������5min�ﵽƽ�⣬ƽ�����������ѹǿΪ��ʼ��1.2������Ҫʹƽ������������ͬ��ֵ����������ȣ�����ʼʱά�ֻ�ѧ��Ӧ���淴Ӧ������У���b��ȡֵ��ΧΪ__________��
��2����1.0molCH4��2.0molH2O(g)ͨ���ݻ�Ϊ10L�ķ�Ӧ�ң���һ�������·�����ӦI�������һ����ѹǿ��CH4��ת�������¶ȵĹ�ϵ��ͼ��
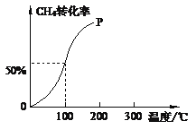
������100 ��ʱ�ﵽƽ�������ʱ��Ϊ5min������H2��ʾ�÷�Ӧ�ķ�Ӧ����Ϊ______��
��100��ʱ��ӦI��ƽ�ⳣ��Ϊ____________��
��3�����ں��º�ѹ�����ڽ��з�ӦII��������˵���÷�Ӧ�ﵽƽ��״̬����________������ţ���
A����2��H��H�����ɵ�ͬʱ�� 3��C��H������
B��CO�ٷֺ������ֲ���
C�������л�������ѹǿ���ֲ���
D�������л��������ܶȱ��ֲ���
��4����ѹǿΪ0.1MPa���¶�Ϊ300�������£���amol CO��3amol H2�Ļ�������ڴ��������·�����ӦII���ɼ״���ƽ����������ݻ�ѹ����ԭ����l/2�������������䣬��ƽ����ϵ������Ӱ����__________������ţ���
A��c(H2) ���� B������Ӧ���ʼӿ죬�淴Ӧ���ʼ���
C��n(CH3OH) ���� D��![]() ��С E��ƽ�ⳣ��K����
��С E��ƽ�ⳣ��K����