��Ŀ����
����Ŀ����CH4��H2OΪԭ�ϣ�ͨ�����з�Ӧ���Ʊ��״���
I��CH4(g) + H2O(g) ![]() CO(g) + 3H2(g) ��H��+206.0kJ��mol��1
CO(g) + 3H2(g) ��H��+206.0kJ��mol��1
II��CO(g) + 2H2(g) ![]() CH3OH(g) ��H����129.0kJ��mol��1
CH3OH(g) ��H����129.0kJ��mol��1
��1��һ���¶��£����ݻ�2L�ҹ̶��������ܱ������У������·�ʽ���뷴Ӧ�����ӦI��һ��ʱ���ﵽƽ�⡣
�� �� | �� | �� |
��Ӧ��Ͷ���� | 1molCH4��1molH2O | a molCH4��a molH2O��b molCO��c molH2 |
���ⶨ����������5min�ﵽƽ�⣬ƽ�����������ѹǿΪ��ʼ��1.2������Ҫʹƽ������������ͬ��ֵ����������ȣ�����ʼʱά�ֻ�ѧ��Ӧ���淴Ӧ������У���b��ȡֵ��ΧΪ__________��
��2����1.0molCH4��2.0molH2O(g)ͨ���ݻ�Ϊ10L�ķ�Ӧ�ң���һ�������·�����ӦI�������һ����ѹǿ��CH4��ת�������¶ȵĹ�ϵ��ͼ��
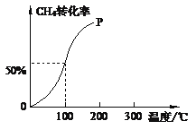
������100 ��ʱ�ﵽƽ�������ʱ��Ϊ5min������H2��ʾ�÷�Ӧ�ķ�Ӧ����Ϊ______��
��100��ʱ��ӦI��ƽ�ⳣ��Ϊ____________��
��3�����ں��º�ѹ�����ڽ��з�ӦII��������˵���÷�Ӧ�ﵽƽ��״̬����________������ţ���
A����2��H��H�����ɵ�ͬʱ�� 3��C��H������
B��CO�ٷֺ������ֲ���
C�������л�������ѹǿ���ֲ���
D�������л��������ܶȱ��ֲ���
��4����ѹǿΪ0.1MPa���¶�Ϊ300�������£���amol CO��3amol H2�Ļ�������ڴ��������·�����ӦII���ɼ״���ƽ����������ݻ�ѹ����ԭ����l/2�������������䣬��ƽ����ϵ������Ӱ����__________������ţ���
A��c(H2) ���� B������Ӧ���ʼӿ죬�淴Ӧ���ʼ���
C��n(CH3OH) ���� D��![]() ��С E��ƽ�ⳣ��K����
��С E��ƽ�ⳣ��K����
���𰸡�0.2��b��1 0.03mol��L��1��min��1 2.25��10��2 BD CD
��������
(1)�跴Ӧ�ļ�������ʵ���Ϊx��
CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
��ʼ��mol��1 1 0 0
��Ӧ��mol��x x x 3x
ƽ�⣨mol��1-x 1-x x 3x
ƽ�����������ѹǿΪ��ʼ��1.2���������ʵ���Ϊ��ʼʱ��1.2������1mol-x��+��1mol-x��+x+3x=��1 mol +1 mol����1.2�����x=0.2mol����Ҫʹƽ������������ͬ��ֵ����������ȣ������ҵ�Ч�����ڸ÷�Ӧǰ����������ʵ������ȣ��ڵ��µ����ʱ����Ҫת��������ʽһ�ߣ����ʵ����ֱ���ȣ���b�����ֵΪ1mol����ʼʱҪά�ֻ�ѧ��Ӧ���淴Ӧ������У���bҪ����0.2mol�����0.2��b��1���ʴ�Ϊ��0.2��b��1��
��2����1.0mol CH4��2.0mol H2O �� g ��ͨ���ݻ��̶�Ϊ10L�ķ�Ӧ�ң���һ�������·�����ӦI����ͼ���֪100������ת����Ϊ50%���ʲμӷ�Ӧ�ļ���Ϊ1mol��50%=0.5mol����
CH4 ��g��+H2O ��g��![]() CO ��g��+3H2 ��g��
CO ��g��+3H2 ��g��
��ʼ����mol����1.0 2.0 0 0
�仯����mol����0.5 0.5 0.5 1.5
ƽ������mol����0.5 1.5 0.5 1.5
�ټ���100��ʱ�ﵽƽ�������ʱ��Ϊ5min������H2��ʾ�÷�Ӧ��ƽ����Ӧ����= =0.03 molL-1min-1��
=0.03 molL-1min-1��
��100��ʱ��ӦI��ƽ��Ũ��Ϊc��CH4��=0.05mol/L��c��H2O��=0.15mol/L��c��CO��=0.05mol/L��c��H2��=0.15mol/L��ƽ�ⳣ��K=![]() =2.25��10-2��
=2.25��10-2��
��3��A����2��H - H�����ɵ�ͬʱ��3��C - H�����ѣ�ֻ˵���淴Ӧ���ʣ�����˵����Ӧ�Ƿ�ﵽƽ��״̬��
B��CO�ٷֺ������ֲ��䣬֤������ֲ��ٱ仯���÷�Ӧ�Ѿ��ﵽ�˻�ѧƽ��״̬��
C��������Ϊ���º�ѹ��������������ѹǿʼ�ղ��䣬�����л�������ѹǿ���仯����˵����Ӧ�Ƿ�ﵽ��ƽ��״̬��
D���÷�Ӧ������Ӧ�������������С�ķ�Ӧ���ں��º�ѹ�����н���ƽ��ʱ���������С��������������غ㣬��������ܶ��������������л��������ܶȱ��ֲ���˵���ﵽƽ��״̬��
��ѡBD��
��4��A��ƽ����������ݻ�ѹ����ԭ����![]() ��ѹǿ����ƽ��������Ӧ�����ƶ����������Ũ����������ƽ�ⳣ�����䣬���ƽ�ⳣ����֪��ƽ��ʱ��Ӧ�����ֵ�Ũ�ȶ�����ѡ��A����
��ѹǿ����ƽ��������Ӧ�����ƶ����������Ũ����������ƽ�ⳣ�����䣬���ƽ�ⳣ����֪��ƽ��ʱ��Ӧ�����ֵ�Ũ�ȶ�����ѡ��A����
B��ѹǿ���������淴Ӧ���ʶ���������Ӧ����������࣬ѡ��B����
C��ѹǿ����ƽ��������Ӧ�����ƶ���CH3OH �����ʵ������ӣ�ѡ��C��ȷ��
D��ѹǿ����ƽ��������Ӧ�����ƶ������������ʵ�����С���״������ʵ�����������ƽ��![]() ��С��ѡ��D��ȷ��
��С��ѡ��D��ȷ��
E��ƽ�ⳣ��ֻ���¶�Ӱ�죬�¶Ȳ��䣬ƽ�ⳣ�����䣬ѡ��E����
��ѡCD��

 ȫ�ܲ����ĩС״Ԫϵ�д�
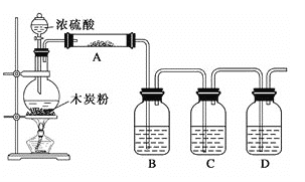
ȫ�ܲ����ĩС״Ԫϵ�д�����Ŀ��ij��ѧ����С�����÷���м(���������Ԫ��)Ϊԭ���Ʊ���������茶���[(NH4)2SO4��FeSO4��6H2O]�����������ͼ��ʾ��װ��(�г�������ȥ)��

��ȡһ�����ı����ȥ���۵ķ���м����ƿ�У�����������ϡ���ᣬ��ͨ���������50~60����ˮԡ�м��ȳ�ַ�Ӧ������ƿ����Һ��ȴ�����º���백ˮ��ʹ�䷴Ӧ��ȫ���Ƶ�dz��ɫ����Һ��
��1�����ͨ������ϡ����������������������ʵ����ѡ��50~60����ˮԡ��ԭ����___����ƿ����Һ��ȴ�����º��ټ��백ˮ��ԭ��__��
��2��Cƿ��KMnO4��Һ��������__��
��3����Ҫȷ�����dz��ɫ����Һ�����з���ʵ��Ҫ�����__(����ĸ)��
a.���������
b.������Һ��ǿ����
c.��ϡ�����ΪŨ����
��4��Ī������һ����Ҫ��ѧҩƷ�����̷��ȶ������ױ������������ǻ�ѧ�����г��õĻ���֮һ������ɿ���(NH4)2SO4FeSO46H2O��(NH4)2Fe(SO4)26H2O��ʾ��һ�������£�(NH4)2Fe(SO4)2�����ֽ⣺4(NH4)2Fe(SO4)2=2Fe2O3+5SO2��+3SO3��+N2��+6NH3��+7H2O����������ȷ����__��
a��Ӧ����amolN2ʱ��ת�Ƶ��ӵ����ʵ���Ϊ6amol
b�÷�Ӧ�Ļ�ԭ�������������������
c��amol����ת��ʱ������SO2�����ʵ���Ϊ0.1amol
d���������������BaCl2��Һ���գ�ֻ�õ�һ�ֳ�����
��5��ʵ��̽����Ӱ����Һ��Fe2+�ȶ��Ե����ء�
����0.8mol/L��FeSO4��Һ��pH=4.5����0.8mol/L��(NH4)2Fe(SO4)2��Һ��pH=4.0������ȡ2ml������Һ����֧�Թ��У��տ�ʼ������Һ����dz��ɫ���ֱ�ͬʱ�μ�2��0.01mol/L��KSCN��Һ������һ����۲�ɼ�(NH4)2Fe(SO4)2��Һ��ȻΪdz��ɫ��������Һ��FeSO4��Һ����ֵ���ɫ���ǡ�
�����ϣ�
���� | Fe(OH)2 | Fe(OH)3 |
��ʼ����pH | 7.6 | 2.7 |
��ȫ����pH | 9.6 | 3.7 |
���������ӷ���ʽ����FeSO4��Һ��������ɫ���ǵ�ԭ��___��
������Ӱ��Fe2+�ȶ��Ե����أ�С��ͬѧ�������3�ּ��裺
����1������������ͬʱ��NH4+�Ĵ���ʹ(NH4)2Fe(SO4)2��Һ��Fe2+�ȶ��ԽϺá�
����2������������ͬʱ����һ��pH��Χ�ڣ���ҺpHԽСFe2+�ȶ���Խ�á�
����3��___��
��6����ȡag���Ƶõ���������茶��壬�ü�����е�����ˮ�ܽ⣬���250mL��Һ��ȡ��25mL������ƿ�У���cmol��L-1KMnO4��Һ�ζ�������KMnO4��ҺVmL������������茶���Ĵ���Ϊ___(�ú�c��V��a�Ĵ���ʽ��ʾ)��