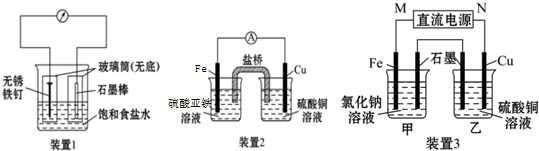
题目内容
3.下列描述中,不符合生产实际的是( )
| A. | 制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 | |
| B. | 在镀件上电镀锌,用锌作阳极 | |
| C. | 用如图1装置生产家用消毒液(NaClO) | |
| D. | 用如图2装置为铅蓄电池充 |
分析 A.加热促进盐的水解,盐酸为挥发性酸;
B.电镀时镀层金属作阳极;
C.生产家用消毒液(NaClO)的原理是让电解氯化钠溶液生成的氯气和氢氧化钠之间发生反应即可;
D.充电时,外接电源的正极与铅蓄电池的正极相连.
解答 解:A.加热促进盐的水解,而且盐酸为挥发性酸,制备AlCl3、FeCl3、CuCl2发生水解生成盐酸,所以不能采用将溶液直接蒸干的方法,故A正确;
B.电镀时镀层金属作阳极,待镀金属作阴极,所以在镀件上电镀锌,用锌作阳极,故B正确;
C.生产家用消毒液(NaClO)的原理是让电解氯化钠溶液生成的氯气和氢氧化钠之间发生反应即可,氯离子在阳极失电子生成氯气,阴极上氢离子得电子生成氢气和氢氧根离子,氯气与氢氧根离子反应生成次氯酸钠,故C正确;
D.充电时,外接电源的正极与铅蓄电池的正极相连,PbO2为正极应该与正极相连,故D错误.
故选D.
点评 本题考查了盐的水解原理、原电池和电解池原理的应用,题目难度不大,注意把握影响水解平衡的因素、电极的判断和电极方程式的书写.

练习册系列答案
相关题目
14.下列物质命名正确的是( )
| A. | 1,3-二甲基丁烷 | B. | 2,3-二甲基-2-乙基己烷 | ||
| C. | 2,3-二甲基-4-乙基戊烷 | D. | 2,3,5-三甲基己烷 |
11.甲、乙、丙三种物质之间能通过一步反应实现转化关系:甲?乙?丙,则甲、丙不可能是( )
| A. | NO HNO3 | B. | CH2=CH2 CH3CHO | C. | Fe FeCL3 | D. | Si H2SiO3 |
18.葡萄酒中的酒精是葡萄果实中的糖发酵后的产物(C6H12O6$\stackrel{酵母}{→}$2CH3CH2OH+2CO2↑).
Ⅰ、已知:实验室制乙烯原理为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,产生的气体能使Br2 的四氯化碳溶液褪色,甲、乙同学用下列实验验证.(气密性已检验,部分夹持装置略).
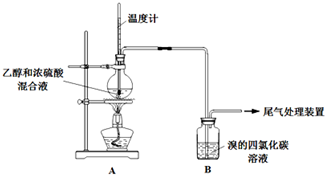
实验操作和现象:
(1)溶液“渐渐变黑”,说明浓硫酸具有脱水性.
(2)分析,甲认为是C2H4,乙认为不能排除SO2的作用.
①根据甲的观点,使B中溶液褪色反应的化学方程式是CH2=CH2+Br2→CH2Br-CH2Br;
②乙根据现象认为实验中产生的SO2和H2O,使B中有色物质反应褪色.
③为证实各自观点,甲、乙重新实验,设计与现象如下:
甲:在A、B间增加一个装有某种试剂的洗气瓶;现象:Br2的CCl4溶液褪色.
乙:用下列装置按一定顺序与A连接:(尾气处理装置略)

现象:C中溶液由红棕色变为浅红棕色时,E中溶液褪色.
请回答下列问题:
a.甲设计实验中A、B间洗气瓶中盛放的试剂是NaOH溶液;乙设计的实验D中盛放的试剂是浓硫酸,装置连接顺序为(d)cabe(f).
b.能说明确实是SO2使E中溶液褪色的实验是加热已经褪色的品红溶液,若红色恢复,证明是SO2使品红溶液褪色而不是Br2.
c.乙为进一步验证其观点,取少量C中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是SO2+2H2O+Br2═4H++2Br-+SO42-、SO42-+Ba2+═BaSO4↓或SO2+2H2O+Br2+Ba2+═4H++2Br-+BaSO4↓.由此可得出的干燥的SO2 不能使Br2 的四氯化碳溶液褪色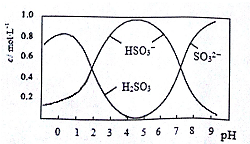
Ⅱ、葡萄酒中常用Na2S2O5做抗氧化剂.
(3)0.5molNa2S2O5溶于水配成1L溶液,该溶液的pH=4.5.溶液中部分微粒浓度随溶液酸碱性变化如右图所示.写出Na2S2O5溶于水时发生的化学方程式Na2S2O5+H2O=2NaHSO3.
(4)已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7.把部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42-沉淀完全[c(SO42-)≤1×10-5mol•L-1],此时溶液中c(SO32-)≤0.05mol•L-1.
Ⅰ、已知:实验室制乙烯原理为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,产生的气体能使Br2 的四氯化碳溶液褪色,甲、乙同学用下列实验验证.(气密性已检验,部分夹持装置略).

实验操作和现象:
| 操 作 | 现 象 |
| 点燃酒精灯,加热至170℃ | Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕,清洗烧瓶 | Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(2)分析,甲认为是C2H4,乙认为不能排除SO2的作用.
①根据甲的观点,使B中溶液褪色反应的化学方程式是CH2=CH2+Br2→CH2Br-CH2Br;
②乙根据现象认为实验中产生的SO2和H2O,使B中有色物质反应褪色.
③为证实各自观点,甲、乙重新实验,设计与现象如下:
甲:在A、B间增加一个装有某种试剂的洗气瓶;现象:Br2的CCl4溶液褪色.
乙:用下列装置按一定顺序与A连接:(尾气处理装置略)

现象:C中溶液由红棕色变为浅红棕色时,E中溶液褪色.
请回答下列问题:
a.甲设计实验中A、B间洗气瓶中盛放的试剂是NaOH溶液;乙设计的实验D中盛放的试剂是浓硫酸,装置连接顺序为(d)cabe(f).
b.能说明确实是SO2使E中溶液褪色的实验是加热已经褪色的品红溶液,若红色恢复,证明是SO2使品红溶液褪色而不是Br2.
c.乙为进一步验证其观点,取少量C中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是SO2+2H2O+Br2═4H++2Br-+SO42-、SO42-+Ba2+═BaSO4↓或SO2+2H2O+Br2+Ba2+═4H++2Br-+BaSO4↓.由此可得出的干燥的SO2 不能使Br2 的四氯化碳溶液褪色

Ⅱ、葡萄酒中常用Na2S2O5做抗氧化剂.
(3)0.5molNa2S2O5溶于水配成1L溶液,该溶液的pH=4.5.溶液中部分微粒浓度随溶液酸碱性变化如右图所示.写出Na2S2O5溶于水时发生的化学方程式Na2S2O5+H2O=2NaHSO3.
(4)已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7.把部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42-沉淀完全[c(SO42-)≤1×10-5mol•L-1],此时溶液中c(SO32-)≤0.05mol•L-1.
8.下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,Z元素的核电荷数为X与Y元素核电荷数之和.下列说法正确的是( )
| X | Y | |
| Z | W | |
| T |
| A. | 氢化物稳定性Y比W强,是因为Y的氢化物中存在氢键 | |
| B. | XY2、XW2、ZY2熔沸点依次增大,都是由共价键形成的分子晶体 | |
| C. | 一定条件下,X单质能与ZY2反应生成Z单质,说明X的非金属性比Z强 | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性,钠能与T形成Na2T2化合物 |
12.有机物的种类繁多,但其命名是有规则的.下列有机物命名正确的是( )
| A. | 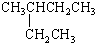 2-乙基丁烷 | B. | CH3CHBr2二溴乙烷 | ||
| C. |  2-甲基丁烯 | D. | 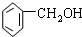 苯甲醇 |
13.还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:CrO42-$→_{转换}^{H+}$Cr2O72- $→_{还原}^{Fe_{2}+}$Cr3+$→_{沉淀}^{OH-}$Cr(OH)3↓ 己知转化过程中的反应为:2CrO42-(aq)+2H+(aq)?Cr2O72-(aq)+H2O(1).转化后所得溶液中铬元素含量为28.6g/L,CrO42-有$\frac{10}{11}$转化为Cr2O72-.下列说法不正确的是( )
| A. | 转化过程中,增大c(H+),平衡向正反应方向移动,CrO42-的转化率提高 | |
| B. | 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5 | |
| C. | 若用绿矾(FeSO4•7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g | |
| D. | 常温下转化反应的平衡常数K=104,则转化后所得溶液的pH=1 |