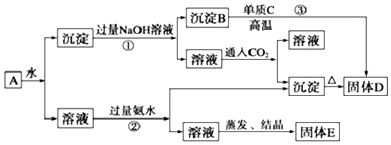
题目内容
7.下列叙述正确的是( )| A. | 同温同压下,相同体积的物质,它们的物质的量相同 | |
| B. | 常温常压下,等质量的N2与CO所含分子数相同 | |
| C. | 同温同体积下,同质量的H2与O2的压强比约为1:16 | |
| D. | A容器中的H2与B容器中的NH3所含原子总数相等,则两容器的体积比为2:1 |
分析 A、同温同压下,相同体积的气体物质,它们的物质的量相同;
B、N2与CO的摩尔质量都是28g/mol;
C、同温同体积下,同质量的H2与O2的压强比与摩尔质量成反应比;
D、在同温同压下,A容器中的H2与B容器中的NH3所含原子总数相等,则两容器的体积比为2:1.
解答 解:A、物质的状态不知,所以物质的量不一定相同,故A错误;
B、N2与CO的摩尔质量都是28g/mol,所以等质量的N2与CO所含物质的量相同,分子数相同,故B正确;
C、同温同体积下,同质量的H2与O2的压强比与摩尔质量成反应比,所以同温同体积下,同质量的H2与O2的压强比约为16:1,故C错误;
D、在同温同压下,A容器中的H2与B容器中的NH3所含原子总数相等,则两容器的体积比为2:1,而条件不知,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数定律及其推论,题目难度中等,明确阿伏伽德罗常数定律及其推论的内容为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
17.用NA表示阿伏加德罗常数的值,卞列叙述正确的是( )
| A. | 含有NA个原子的氢气在标准状况下的体积约为22.4L | |
| B. | 25℃,1.01×105Pa,64gS02中含有的原子数为3NA | |
| C. | 40gNaOH溶解在1L水中,则其100 mL溶液中含Na+数为0.1NA | |
| D. | 标准状况下,11.2 LH20含有的分子数为0.5NA |
15.下列行为中符合安全要求的是( )
| A. | 进入煤矿矿井时,用火把照明 | |
| B. | 用点燃的火柴在液化气钢瓶口检验是否漏气 | |
| C. | 实验时,蒸发结晶时,当有大量晶体析出时再用玻璃棒搅拌 | |
| D. | 装运乙醇的包装箱上应贴上易燃液体的危险品标志图标 |
2.物质不需要通过化学变化就能体现的性质是( )
| A. | 可燃性 | B. | 不稳定性 | C. | 挥发性 | D. | 氧化性 |
12.完成下列实验所需要的玻璃仪器种类最多的是( )
| A. | 分离甲苯和二甲苯混合物 | B. | 分离硝酸苯和水的混合物 | ||
| C. | 分离碳酸钡和碳酸钠溶液 | D. | 分离碘的四氯化碳和水 |
16.某化学兴趣小组设计以下实验步骤与操作来定性检验茶叶中含有的少量钙、铁、铝三种元素.
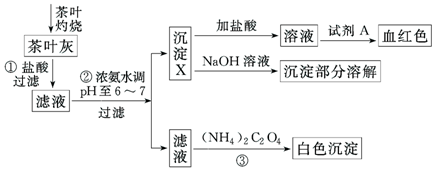
已知Ca2+、Al2+、Fe3+完全形成相应氢氧化物沉淀的pH如下表:
(1)步骤①中加入盐酸的作用是使茶叶中的钙、铁、铝元素转化为离子.
(2)步骤②中调节pH至6~7的目的是使Fe3+、Al3+转化为沉淀.
(3)沉淀X所含主要物质的化学式为Al(OH)3、Fe(OH)3 .
(4)写出沉淀X与NaOH溶液反应的化学方程式Al(OH)3+NaOH=NaAlO2+2H2O;写出步骤③中发生反应的离子方程式:Ca2++C2O42-=CaC2O4↓.
(5)试剂A为硫氰化钾溶液.

已知Ca2+、Al2+、Fe3+完全形成相应氢氧化物沉淀的pH如下表:
| Ca(OH)2 | Al(OH)3 | Fe(OH)3 | |
| pH | ≥13 | ≥5.2 | ≥4.1 |
(2)步骤②中调节pH至6~7的目的是使Fe3+、Al3+转化为沉淀.
(3)沉淀X所含主要物质的化学式为Al(OH)3、Fe(OH)3 .
(4)写出沉淀X与NaOH溶液反应的化学方程式Al(OH)3+NaOH=NaAlO2+2H2O;写出步骤③中发生反应的离子方程式:Ca2++C2O42-=CaC2O4↓.
(5)试剂A为硫氰化钾溶液.
8.下列离子方程式书写正确的是( )
| A. | 在强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3+4OH-═2FeO42-+3Cl-+5H2O | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 铜溶于浓硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ |