题目内容
14.某研究性学习小组以甲酸为原料在实验室完成了一氧化碳和甲酸铜两种物质的制备实验.实验一、用甲酸制备一氧化碳
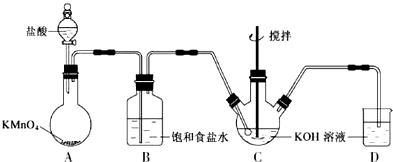
CO的制备原理:HCOOH$→_{△}^{浓H_{2}SO_{4}}$CO↑+H2O,制备装置如图1(其中夹持仪器、加热仪器没有画出)
(1)b仪器的名称为温度计,c的作用是防倒吸.
(2)制备CO时,浓硫酸与甲酸的混合方式是先加热浓硫酸至80℃-90℃,再逐滴滴入甲酸.
实验二、用甲酸制备甲酸铜
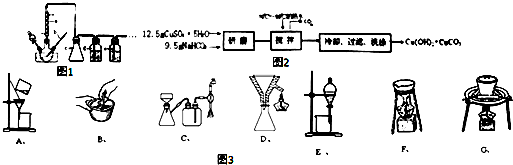
步骤一:碱式碳酸铜的制备如图2所示
步骤二:甲酸铜的制备
将产品碱式碳酸铜放入烧杯内,加入约20mL蒸馏水,加热搅拌至323K左右,逐滴加入适量甲酸至沉淀完全溶解,趁热过滤,滤液在通风橱下蒸发至原体积的$\frac{1}{3}$左右,冷却至室温,减压过滤,洗涤,得Cu(HCOO)2•4H2O产品,称量,计算产率.回答下列问题:
(3)在制备碱式碳酸铜的过程中,如果温度过高,对产物有何影响?温度过高导致Cu(OH)2?CuCO3分解.
(4)步骤二中碱式碳酸铜滴入甲酸生成四水合甲酸铜的化学方程式为Cu(OH)2•CuCO3+4HCOOH+5H2O═Cu(HCOO)2•4H2O+CO2↑.
(5)本实验涉及三种固液分离的方法.
①倾析法使用到的仪器有烧杯、玻璃棒;
②采用减压过滤的装置对步骤二中溶解后的溶液进行趁热过滤;
③步骤二的实验中,需用到如图3装置CDF.
(6)最终称量所得的产品为7.91g,则产率为70%.
分析 (1)根据图1可以看出b仪器为温度计,c为安全瓶;
(2)制备CO时,先加热浓硫酸至80℃-90℃,再逐滴滴入甲酸;
(3)碱式碳酸铜不稳定,温度过高容易分解;
(4)碱式碳酸铜滴入甲酸生成四水合甲酸铜和二氧化碳,据此书写方程式;
(5)①根据倾析法的操作方法选用仪器;
③根据步骤(Ⅱ)中制备甲酸铜的操作步骤选用需要的仪器;
(6)根据n=$\frac{m}{M}$计算出硫酸铜晶体、碳酸氢钠的物质的量,然后根据不足量计算出生成碱式碳酸铜的物质的量,再根据反应Cu(OH)2•CuCO3+4HCOOH+5H2O═Cu(HCOO)2•4H2O+CO2↑计算出理论上生成甲酸铜晶体的质量,最后计算出产率.
解答 解:(1)根据图1可以看出b仪器为温度计;因为HCOOH易溶于水,会发生倒吸现象,需在收集前加一个安全瓶,所以c为安全瓶作用防倒吸,
故答案为:温度计;防倒吸;
(2)制备CO时,先加热浓硫酸至80℃-90℃,再逐滴滴入甲酸;故答案为:先加热浓硫酸至80℃-90℃,再逐滴滴入甲酸;
(3)用于碱式碳酸铜不稳定,温度过高导致Cu(OH)2?CuCO3分解生成黑色的氧化铜、二氧化碳气体和水,影响其产率,
故答案为:温度过高导致Cu(OH)2?CuCO3分解;
(4)碱式碳酸铜滴入甲酸生成四水合甲酸铜和二氧化碳,则方程式为Cu(OH)2•CuCO3+4HCOOH+5H2O═Cu(HCOO)2•4H2O+CO2↑;故答案为:Cu(OH)2•CuCO3+4HCOOH+5H2O═Cu(HCOO)2•4H2O+CO2↑;
(5)①倾析法分离溶液时,选用使用到烧杯和用于引流的仪器玻璃棒,
故答案为:烧杯、玻璃棒;
③根据甲酸铜的制备步骤可知,需要减压过滤、趁热过滤和蒸发装置,所以需要的装置有C、D、F,
故答案为:CDF;
(6)12.5g硫酸铜晶体的物质的量为:$\frac{12.5g}{250g/mol}$=0.05mol,
9.5g碳酸氢钠的物质的量为:$\frac{9.5g}{84g/mol}$≈0.113mol,
根据反应2CuSO4+4NaHCO3═Cu(OH)2•CuCO3↓+3CO2↑+2Na2SO4+H2O可知,碳酸氢钠过量,反应生成的碱式碳酸铜的物质的量为0.05mol,
根据反应Cu(OH)2•CuCO3+4HCOOH+5H2O═Cu(HCOO)2•4H2O+CO2↑可知,生成甲酸铜的物质的量为0.05mol,
所以甲酸铜的产率为:$\frac{7.91g}{226g/mol×0.05mol}$×100%=70%,
故答案为:70%.
点评 本题通过用甲酸制备一氧化碳、甲酸铜晶体的制备,考查物质性质实验方案的设计方法,题目难度中等,试题涉及的知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验、化学计算能力,是一道质量较好的试题.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案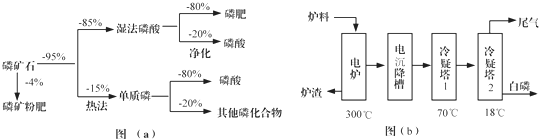
部分物质的相关性质如下:
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
| SiF4 | -90 | -86 | 易水解 |
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的69%;
(2)以磷矿石为原料,湿法磷酸过程中Ca5F(PO4)3反应化学方程式为:Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑.现有1t折合含有P2O5约30%的磷灰石,最多可制得到85%的商品磷酸0.49t.
(3)如图(b)所示,热法磷酸生产过程的第一步是将SiO2、过量焦炭与磷灰石混合,高温反应生成白磷.炉渣的主要成分是CaSiO3(填化学式).冷凝塔1的主要沉积物是液态白磷,冷凝塔2的主要沉积物是固态白磷.
(4)尾气中主要含有SiF4、CO,还含有少量的PH3、H2S和HF等.将尾气先通入纯碱溶液,可除去SiF4、H2S、HF;再通入次氯酸钠溶液,可除去PH3.(均填化学式)
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是产品纯度高.
| 化学键 | N≡N | F-F | N-F |
| 键能:kJ/mol | 941.7 | 154.8 | 283.0 |
| A. | 过程F2(g)→2F(g)吸收能量 | |
| B. | 过程N(g)+3F(g)→NF3(g) 放出能量 | |
| C. | 反应N2(g)+3F2(g)=2NF3(g) 放出能量 | |
| D. | NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应 |
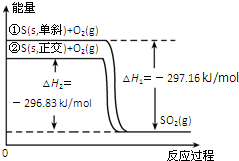
| A. | 单斜硫转化为正交硫的反应是吸热反应 | |
| B. | 正交硫比单斜硫稳定 | |
| C. | 相同物质的量的正交硫比单斜硫所含有的能量高 | |
| D. | ①表示断裂1mol O2中的共价键所吸收的能量比形成lmolSO2中的共价键所放出的能量少297.16 kJ |
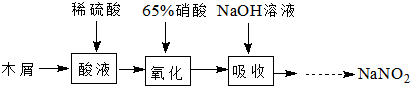
 亚硝酸钠可大量用于染料和有机合成工业.
亚硝酸钠可大量用于染料和有机合成工业.