题目内容
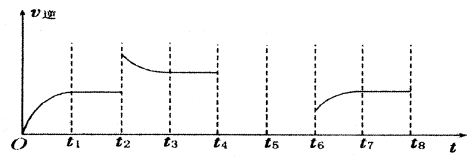
二氧化硫的催化氧化原理为2SO2(g)+O2(g) 2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是
2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是
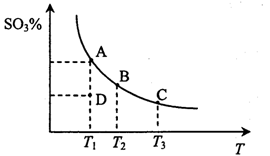
A.在D点时v E<v逆
B.反应2SO2(g)+O2(g) 2SO3(g)的△H<0
2SO3(g)的△H<0
C.若B、C点的平衡常数分别为KB、KC,则KB>KC
D.恒温恒压下向平衡体系中通入氦气,平衡向左移动
 2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是
2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是
A.在D点时v E<v逆
B.反应2SO2(g)+O2(g)
 2SO3(g)的△H<0
2SO3(g)的△H<0C.若B、C点的平衡常数分别为KB、KC,则KB>KC
D.恒温恒压下向平衡体系中通入氦气,平衡向左移动
A
试题分析:A、D点反应没有达到平衡状态,如果要达到平衡状态,则应保持温度不变,进行到A点即达到平衡,在反应过程中SO3的百分含量增加,这说明反应向正反应方向进行,因此正反应速率大于逆反应速率,A不正确;B、随着温度的升高,SO3的百分含量降低。这说明升高温度平衡向逆反应方向移动,因此正方应是放热反应△H<0,B正确;C、C点温度高于B点温度,温度平衡向逆反应方向移动,平衡常数减小,所以B点平衡常数大于C点平衡常数,C正确;D、恒温恒压下向平衡体系中通入氦气,容器的容积增大,相当于是将原平衡体系降低压强,所以平衡向体积增大的逆反应方向,即向左移动,D正确,答案选A。

练习册系列答案
相关题目
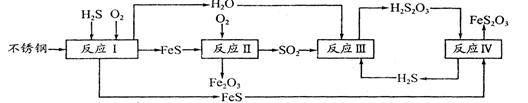
 H2S(g) △H=+21.6kJ·mol-1。反应达到平衡时H2、S、H2S的物质的量均为3 mol,则380 K时该反应的化学平衡常数为______;下列对该反应分析正确的是______(填字母序号)。
H2S(g) △H=+21.6kJ·mol-1。反应达到平衡时H2、S、H2S的物质的量均为3 mol,则380 K时该反应的化学平衡常数为______;下列对该反应分析正确的是______(填字母序号)。
 pC(g)+qD(g) ΔH<0。下列结论中错误的是
pC(g)+qD(g) ΔH<0。下列结论中错误的是 2 SO3(g)。已知反应过程某一时刻SO2、O2、SO3浓度(mol?L-1)分别为0.2、0.1、0.2,达到平衡时,浓度可能正确的是( )
2 SO3(g)。已知反应过程某一时刻SO2、O2、SO3浓度(mol?L-1)分别为0.2、0.1、0.2,达到平衡时,浓度可能正确的是( )
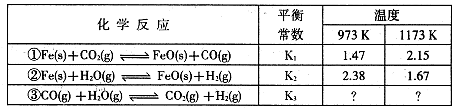
 H2 (g) +CO2 (g)平衡常数K随温度的变化如下表:
H2 (g) +CO2 (g)平衡常数K随温度的变化如下表:
 2CO (g)平衡常数K1;
2CO (g)平衡常数K1; CO(g) +H2 (g)平衡常数K2则K、K1、K2,之间的关系是 :
CO(g) +H2 (g)平衡常数K2则K、K1、K2,之间的关系是 : 2HI(g)达到平衡的标志是
2HI(g)达到平衡的标志是 pC(g)+qD(g),
pC(g)+qD(g),