题目内容
6.已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1;②2H2(g)+O2(g)═2H2O(g)△H2;③2H2(g)+O2(g)═2H2O(l)△H3.
室温取体积比为4:1的甲烷和氢气11.2L(已换算成标准状况),经完全燃烧后恢复至室温,放出的热量为( )
| A. | -(0.4 mol×△H1+0.05 mol×△H3) | B. | -(0.4 mol×△H1+0.05 mol×△H2) | ||
| C. | -(0.4 mol×△H1+0.1 mol×△H3) | D. | -(0.4 mol×△H1+0.1 mol×△H2) |
分析 根据混合气体的体积计算混合气体的物质的量,结合气体体积比计算甲烷、氢气的物质的量,再根据热化学反应方程式计算放出的热量,注意燃烧后恢复至常温,氢气燃烧放出的热量应选择生成液态水的热化学反应方程式计算.
解答 解:甲烷和氢气的混合气体11.2L(已折合成标准状况),所以甲烷和氢气的混合气体的总的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,
甲烷和氢气的体积比为4:1,所以甲烷的物质的量为0.5mol×$\frac{4}{5}$=0.4mol,氢气的物质的量为0.5mol-0.4mol=0.1mol.
由CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1可知,
0.4mol甲烷燃烧放出的热量为-0.4mol×△H1=-0.4mol△H1;
由2H2(g)+O2(g)═2H2O(l)△H3可知,
0.1mol氢气燃烧生成液态水放出的热量为-0.1mol×$\frac{1}{2}$×△H3=-0.05mol△H3.
所以放出的热量为-(0.4 mol×△H1+0.05 mol×△H3)
故选:A.
点评 本题考查根据热化学方程式的计算,难度不大,注意热化学方程式的意义即可解答.

练习册系列答案
相关题目
9.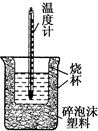 50mL 0.5mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.5mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)从实验装置上看,图中尚缺少一种玻璃仪器是环形玻璃搅拌棒.
(2)大烧杯上如不盖硬纸板,测得的中和热偏大(填“偏大”或“偏小”或“无影响”).
(3)实验中改用60mL 0.50mol•L-1盐酸跟50mL 0.50mol•L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“偏大”或“相等”或“偏小”),所求中和热相等(填“相等”或“不相等”),简述理由:因中和热是指稀强酸与稀强碱发生中和反应生成1molH2O放出的热量,与酸碱的用量无关.
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会偏小;用50mL 0.5mol•L-1盐酸与50mL 0.50mol•L-1 NaOH溶液进行中和测定,测得的中和热数值会无影响.(填“偏大”、“偏小”或“无影响”)
(5)取50mL 0.50mol/L NaOH溶液和30mL0.50mol/L硫酸溶液进行实验,实验数据如下表.
则中和热△H=-53.8kJ/mol(取小数点后一位).
(本题中NaOH溶液和硫酸溶液的密度均取1g/mL,溶液的比热容均取4.2J/(g.℃))
 50mL 0.5mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.5mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少一种玻璃仪器是环形玻璃搅拌棒.
(2)大烧杯上如不盖硬纸板,测得的中和热偏大(填“偏大”或“偏小”或“无影响”).
(3)实验中改用60mL 0.50mol•L-1盐酸跟50mL 0.50mol•L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“偏大”或“相等”或“偏小”),所求中和热相等(填“相等”或“不相等”),简述理由:因中和热是指稀强酸与稀强碱发生中和反应生成1molH2O放出的热量,与酸碱的用量无关.
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会偏小;用50mL 0.5mol•L-1盐酸与50mL 0.50mol•L-1 NaOH溶液进行中和测定,测得的中和热数值会无影响.(填“偏大”、“偏小”或“无影响”)
(5)取50mL 0.50mol/L NaOH溶液和30mL0.50mol/L硫酸溶液进行实验,实验数据如下表.
| 温度 实验次数 | 起始温度T1/℃ | 终止温度T2/℃ | 温度差平均值(T2-T1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 30.1 | ||
| 2 | 27.0 | 27.4 | 33.3 | ||
| 3 | 25.9 | 25.9 | 29.8 | ||
| 4 | 26.4 | 26.2 | 30.4 | ||
(本题中NaOH溶液和硫酸溶液的密度均取1g/mL,溶液的比热容均取4.2J/(g.℃))
14.下列离子方程式正确的是( )
| A. | 过量氯气通入溴化亚铁溶液中2Fe2++2Br-+2Cl2═Fe3++Br2+4Cl- | |
| B. | 向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O | |
| C. | 碳酸氢钙和过量的氢氧化钠溶液反应:Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| D. | 用FeCl3溶液腐蚀印刷电路板:Cu+Fe3+=Fe2++Cu2+ |
1.已知下列四个热化学方程式:
NH4Cl(s)═NH3(g)+HCl(g)△H1=a(i)
Ba(OH)2•8H2O(s)═BaO(s)+9H2O(1)△H2=b(ii)
2NH4Cl(s)+Ba(OH)2•8H2O(s)═BaCl2(aq)+2NH3(g)+10H2O(1)△H3=c(iii)
BaO(s)+2HCl(aq)═BaCl2(aq)+H2O(1)△H4=d(iv)
其中a、b、c 均大于0,HCl气体溶解于水,溶液温度升高.由此可知下列判断一定正确的是( )
NH4Cl(s)═NH3(g)+HCl(g)△H1=a(i)
Ba(OH)2•8H2O(s)═BaO(s)+9H2O(1)△H2=b(ii)
2NH4Cl(s)+Ba(OH)2•8H2O(s)═BaCl2(aq)+2NH3(g)+10H2O(1)△H3=c(iii)
BaO(s)+2HCl(aq)═BaCl2(aq)+H2O(1)△H4=d(iv)
其中a、b、c 均大于0,HCl气体溶解于水,溶液温度升高.由此可知下列判断一定正确的是( )
| A. | d<0 | B. | c<2a+b+d | C. | c=2a+b+d | D. | c>2a+b+d |
11.用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A. | 10 L 0.l mol•L-1的Na2CO3溶液中离子总数一定大于3NA | |
| B. | 标准状况下,22.4 L HF的分子数为NA | |
| C. | 1 mol Fe在22.4 L的Cl2(标准状况下)中燃烧,转移的电子总数为3NA | |
| D. | 一定条件下某密闭容器盛有0.1 mol N2和0.3 mol H2,充分反应后转移电子数为0.6NA |
18.下列每组物质内,凡同种元素均显示相同化合价的是( )
| A. | K2MnO4和KMnO4 | B. | CuCO3、Cu(OH)2、Cu2(OH)2CO3 | ||
| C. | NH4NO3和NaNO2 | D. | NaHSO4和Na2SO3 |
15.下列离子方程式正确的是( )
| A. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 浓烧碱溶液中加入铝片:A1+2OH-═A1O2-+H2↑ | |
| C. | NO2与水的反应:3NO2+H2O═2NO3-+NO+2H+ | |
| D. | 用KIO3 氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- |

 、
、