题目内容
4.下列物质中,既有离子键又有共价键的是( )| A. | MgCl2 | B. | NH3 | C. | NH4Cl | D. | C2H2 |
分析 一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,以此来解答.
解答 解:A.氯化镁只含离子键,故A不选;
B.氨气只含共价键,故B不选;
C.氯化铵含离子键、N-H共价键,故C选;
D.乙炔只含共价键,故D不选;
故选C.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大.

练习册系列答案
相关题目
17.Fenton试剂常用于处理含难降解有机物的工业废水.通常是在含有亚铁离子的酸性溶 液中投加过氧化氢,在Fe2+催化剂作用下,H2O2能产生活泼的羟基自由基,从而引发和传播自由基链反应,加快有机物和还原性物质的氧化.
(1)请写出羟基自由基的电子式
(2)羟基自由基的氧化能力仅次于氟,可以与大多数有机污染物发生快速的链式反应,无选择性地把有害物质氧化成CO2、H2O,请写出羟基自由基与废水中苯酚反应的方程式C6H6O+28•OH═6CO2↑+17H2O.
(3)已知Fe3++SCN=Fe (SCN)2+,在一定温度下该反应达到平衡时c (Fe3+)=0.04mol/L,c (SCN-)=0.1mol/L,c[Fe (SCN) 2+]=0.68mol/L,则此温度下该反应的平衡常数K=170L/mol.有同学利用该反应来检验Fenton试剂中是否产生Fe3+,你认为该办法是否可行,请说明理由不可行,羟基自由基会氧化SCN-.
(4)现运用Fenton试剂降解有机污染物p-CP,试探究有关因素对该降解反应速率的影响.实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K (其余实验条件 见下表)设计如下对比实验.
请将表中相应序号处内容补充完整①313②3 ⑤探究溶液pH大小对反应速率的影响.
(5)实验测得p-CP的浓度随时间变化的关系如图所示.
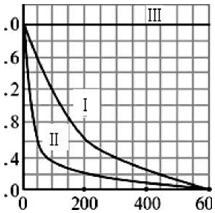
a请根据上图实验I曲线,计算降解反应在50-300s内的平均反应速率v (p-CP)=4.8×10-6mol/(L•s),以及300s时p-CP的降解率为80%;
b.实验I、II表明温度升高,降解反应速率增大(填“增大”、“减小”或“不变”);
c.实验III得出的结论是:pH=10时,反应基本停止.
(1)请写出羟基自由基的电子式

(2)羟基自由基的氧化能力仅次于氟,可以与大多数有机污染物发生快速的链式反应,无选择性地把有害物质氧化成CO2、H2O,请写出羟基自由基与废水中苯酚反应的方程式C6H6O+28•OH═6CO2↑+17H2O.
(3)已知Fe3++SCN=Fe (SCN)2+,在一定温度下该反应达到平衡时c (Fe3+)=0.04mol/L,c (SCN-)=0.1mol/L,c[Fe (SCN) 2+]=0.68mol/L,则此温度下该反应的平衡常数K=170L/mol.有同学利用该反应来检验Fenton试剂中是否产生Fe3+,你认为该办法是否可行,请说明理由不可行,羟基自由基会氧化SCN-.
(4)现运用Fenton试剂降解有机污染物p-CP,试探究有关因素对该降解反应速率的影响.实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K (其余实验条件 见下表)设计如下对比实验.
| 实验编号 | 实验目的 | T/K | pH | c/10-3mol•L-1 | |
| H2O2 | Fe2+ | ||||
| I | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| II | 探究温度对降解速率的影响 | ① | ② | ③ | ④ |
| III | ⑤ | 298 | 10 | 6.0 | 0.30 |
(5)实验测得p-CP的浓度随时间变化的关系如图所示.

a请根据上图实验I曲线,计算降解反应在50-300s内的平均反应速率v (p-CP)=4.8×10-6mol/(L•s),以及300s时p-CP的降解率为80%;
b.实验I、II表明温度升高,降解反应速率增大(填“增大”、“减小”或“不变”);
c.实验III得出的结论是:pH=10时,反应基本停止.
12.设NA为阿伏加德罗常数.下列说法正确的是( )
| A. | 0.1 molFe和0.1molCu分别与0.1molCl2完全反应,转移的电子数均为0.2NA个 | |
| B. | 4.6g有机物C2H6O的分子结构中含有的C-H键数目一定为0.5NA | |
| C. | 1 mol FeCl3 水解生成的Fe(OH)3胶粒数为NA | |
| D. | 64 g SO2与过量的O2在一定条件下反应生成的SO3分子数为NA |
12.若把长式元素周期表原先的副族、主族及族号取消,由左至右改为18列,如碱金属元素为第1列,稀有气体元素为第18列.按此规定,下列说法中错误的是( )
| A. | 第9列元素中没有非金属元素 | |
| B. | 只有第2列元素原子最外层有2个电子 | |
| C. | 第16列元素均为非金属元素 | |
| D. | 在整个18列元素中,第3列的元素种类最多 |
19. 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 原子半径:T>Q>R | |
| B. | Q元素在自然界中没有游离态 | |
| C. | 最高价氧化物对应水化物的酸性:Q<W | |
| D. | 气态氢化物的热稳定性:Q>R |
9.下列物质能发生消去反应,但不能发生催化氧化反应的是( )
| A. |  | B. | (CH3)2CHOH | ||
| C. | CH3CH2C(CH3)2CH2OH | D. | CH3CH2C(CH3)2OH |
16.下列叙述错误的是( )
| A. | 乙烯使溴水褪色是因为发生了加成反应 | |
| B. | 二氧化硫使溴水褪色是因为发生了氧化还原反应 | |
| C. | 用乙酸和乙醇反应制备乙酸乙酯发生了酯化反应 | |
| D. | 除去乙酸乙酯中的少量乙酸常用氢氧化钠溶液洗涤 |
13.下列叙述正确的是( )
| A. | 分子式相同的有机物一定是同种物质 | |
| B. | 通式相同的不同物质一定属于同系物 | |
| C. | 相对分子质量相同的不同物质一定是同分异构体 | |
| D. | 同分异构体之间的转化一定是化学变化 |
14.下列金属冶炼原理错误的是( )
| A. | 2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑ | B. | Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2 | ||
| C. | MgO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Mg+H2O | D. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ |