题目内容
4.下列离子方程式正确的是( )| A. | 硫酸与氢氧化钡溶液反应:H++OH-═H2O | |
| B. | 碳酸钙与稀硝酸反应:CO32-+2H+═H2O+CO2↑ | |
| C. | 实验室用氢氧化钠溶液吸收多余的Cl2:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 氯化镁溶液与氢氧化钠溶液反应:Mg2++OH-═Mg(OH)2↓ |
分析 A.漏掉了钡离子与硫酸根离子生成硫酸钡的反应;
B.碳酸钙为难溶物,离子方程式中碳酸钙不能拆开;
C.氢氧化钠溶液与氯气反应生成氯化钠、次氯酸钠和水;
D.离子方程式两边总电荷不相等,违反了电荷守恒.
解答 解:A.硫酸与氢氧化钡溶液反应生成硫酸钡沉淀和水,正确的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故A错误;
B.碳酸钙不能拆开,正确的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故B错误;
C.实验室用氢氧化钠溶液吸收多余的Cl2,反应的离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O,故C正确;
D.氯化镁溶液与氢氧化钠溶液反应生成氢氧化镁沉淀和氯化钠,正确的离子方程式为:Mg2++2OH-═Mg(OH)2↓,故D错误;
故选C.
点评 本题考查了离子方程式的书写方法,题目难度不大,注意明确离子方程式正误判断常用方法:,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.

练习册系列答案
相关题目
15.下列配制物质的量浓度的溶液操作中,会导致实验结果偏低的是( )
| A. | 定容时不慎使液面超过刻度 | |
| B. | 容量瓶中有少量的水,配制前未进行干燥处理 | |
| C. | 未将洗涤玻璃棒和烧杯的洗涤液转入容量瓶中 | |
| D. | 定容时,俯视看刻度 |
12.香兰素是重要的香料之一,它可由丁香酚合成,如图所示,有关两种化合物的说法正确的是( )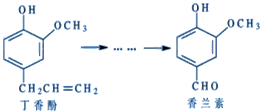

| A. | 常温下,1 mol丁香酚只能与1 mol Br2反应 | |
| B. | 丁香酚不能与FeCl3溶液发生显色反应 | |
| C. | 1 mol香兰素最多能与3 mol氢气发生加成反应 | |
| D. | 香兰素分子中至少有12个原子共平面 |
19.下列化学用语正确的是( )
| A. | 氯化钠的电子式: | |
| B. | 氯离子的结构示意图: | |
| C. | 乙烯的分子式:CH2=CH2 | |
| D. | 氢氧化钠的电离方程式:NaOH═Na++O2-+H+ |
9.给出化学式的下列物质中,其俗名和所属分类都正确的是( )
| A. | NaOH:苛性钠 电解质 | B. | CHCl3:氯仿 盐 | ||
| C. | CH3COOH:醋酸 离子化合物 | D. | CuSO4•5H2O:胆矾 混合物 |
16.某1L溶液中含有大量的Cl-、Br-、I-,若向1L该溶液中通入一定量的氯气,溶液中Cl-、Br-、I-的物质的量与通入的氯气的体积(标准状况)的量关系如表所示,分析后判断下列说法正确的是( )
| V(Cl2)(标况,L) | 2.8 | 5.6 | 11.2 |
| n(Cl-) mol | 1.5 | 1.75 | 2.25 |
| n(Br-) mol | 1.5 | 1.4 | 0.9 |
| n(I-)mol | a | 0 | 0 |
| A. | 当通入氯气的体积为2.8L时,溶液中发生的离子反应式只有:Cl2+2I-═2Cl-+I2 | |
| B. | 表中a的值为0.5 | |
| C. | 原溶液中Cl-、Br-、I-物质的量之比为15:15:8 | |
| D. | 原溶液中I-的物质的量浓度为0.25mol/L |
14.现有甲、乙两种易溶于水的化合物,已知甲的水溶液不导电,乙的水溶液能导电,下列有关说法正确的是( )
| A. | 甲一定是共价化合物,乙一定是离子化合物 | |
| B. | 甲一定是共价化合物,乙可能是共价化合物 | |
| C. | 甲可能是离子化合物,乙可能是共价化合物 | |
| D. | 甲一定是离子化合物,乙可能是共价化合物 |