题目内容
19.设NA为阿伏加德罗常数的数值,下列说法正确的是( )| A. | 标准状况下,2.24L由O2和O3组成的混合气体中含有的原子数为0.2NA | |
| B. | 1L0.1mol•L-1NaHCO3溶液中所含HCO3-的数目为0.1NA | |
| C. | 一定条件下,0.1molCO与0.1molH2O(g)充分反应,生成H2的分子数为0.1NA | |
| D. | 在反应:3FeS2+12C+8O2═Fe3O4+12CO+6S中,每生成0.6molS,转移的电子数为3.2NA |
分析 A.1个氧气分子含有2个氧原子,1个臭氧分子含有3个氧原子;
B.碳酸氢根离子为弱酸的酸式根离子,水溶液中部分水解;
C.一氧化碳与水蒸汽反应为可逆反应;
D.反应3FeS2+12C+8O2=Fe3O4+12CO+6S中,Fe元素化合价部分由+2价升高到+3价,S元素化合价由-1价升高到0价,C元素化合价由0价升高到+2价,O由0价降为-2价,据此解答.
解答 解:A.标准状况下,2.24L由O2和O3组成的混合气体物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,含有的原子数大于0.2NA,故A错误;
B.碳酸氢根离子为弱酸的酸式根离子,水溶液中部分水解,所以1L0.1mol•L-1NaHCO3溶液中所含HCO3-的数目小于0.1NA,故B错误;
C.一氧化碳与水蒸汽反应为可逆反应,可逆反应不能进行到底,所以一定条件下,0.1molCO与0.1molH2O(g)充分反应,生成H2的分子数小于0.1NA,故C错误;
D.从化学方程式可看出Fe、S、C三种元素的化合价均升高,所以被氧化的物质为FeS2和C,生成0.6硫时,消耗0.8mol氧气,转移电子0.8mol×4=3.2mol,转移的电子数为3.2NA,故D正确;
故选:D.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件为解答关键,试题培养了学生的化学计算能力.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
9. 水是生命的源泉、工业的血液、城市的血脉.要保护好河流,因为河水是主要的饮用水源,污染物通过饮用水可直接毒害人体,也可通过食物链和灌溉农田间接危及健康.请回答下列问题:
水是生命的源泉、工业的血液、城市的血脉.要保护好河流,因为河水是主要的饮用水源,污染物通过饮用水可直接毒害人体,也可通过食物链和灌溉农田间接危及健康.请回答下列问题:
(1)纯水在T℃时,pH=6,该温度下1mol•L-1的NaOH溶液中,由水电离出的c(OH-)=10-12 mol•L-1.
(2)25℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其主要水解反应的离子方程式为CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-,由水电离出的c(OH-)=0.001mol•L-1.
(3)体积均为100mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数小于(填“大于”“小于”或“等于”)CH3COOH的电离平衡常数.理由是稀释相同倍数,一元酸HX的pH变化量比CH3COOH的小,故酸性较弱,电离平衡常数较小.
(4)电离平衡常数是衡量弱电解质电离程度的物理量.已知:
①25℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三溶液的pH由大到小的顺序为Na2CO3溶液>NaCN溶液>CH3COONa溶液(用化学式表示).
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3.
(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7 mol•L-1(填精确值),c(CH3COO-)/c(CH3COOH)=18.
 水是生命的源泉、工业的血液、城市的血脉.要保护好河流,因为河水是主要的饮用水源,污染物通过饮用水可直接毒害人体,也可通过食物链和灌溉农田间接危及健康.请回答下列问题:
水是生命的源泉、工业的血液、城市的血脉.要保护好河流,因为河水是主要的饮用水源,污染物通过饮用水可直接毒害人体,也可通过食物链和灌溉农田间接危及健康.请回答下列问题:(1)纯水在T℃时,pH=6,该温度下1mol•L-1的NaOH溶液中,由水电离出的c(OH-)=10-12 mol•L-1.
(2)25℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其主要水解反应的离子方程式为CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-,由水电离出的c(OH-)=0.001mol•L-1.
(3)体积均为100mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数小于(填“大于”“小于”或“等于”)CH3COOH的电离平衡常数.理由是稀释相同倍数,一元酸HX的pH变化量比CH3COOH的小,故酸性较弱,电离平衡常数较小.
(4)电离平衡常数是衡量弱电解质电离程度的物理量.已知:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3.
(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7 mol•L-1(填精确值),c(CH3COO-)/c(CH3COOH)=18.
10.用石油和煤可以得到有机化工生产中需要的众多原料,例如由石油得到的乙烯和由煤得到的苯制聚苯乙烯.生产过程如下:
①CH2═CH2+ →
→
② $\stackrel{-H_{2}}{→}$
$\stackrel{-H_{2}}{→}$ 
③ →
→
下列说法不正确的是( )
①CH2═CH2+
 →
→
②
 $\stackrel{-H_{2}}{→}$
$\stackrel{-H_{2}}{→}$ 
③
 →
→
下列说法不正确的是( )
| A. | 通过裂解可以从石油中获得更多的乙烯 | |
| B. | 把煤干馏可以得到粗苯,经分馏可以得到苯 | |
| C. | 制聚苯乙烯的反应①为取代反应,②为消去反应③为加聚反应 | |
| D. | 反应①②③的原子利用率不都为100% |
14.化学与生活密切相关,下列说法错误的是( )
| A. | 将燃油车改为燃气车有利于减少污染物排放 | |
| B. | 含氟牙膏能有效预防龋齿,且其中所加氟化物的量宜多不宜少 | |
| C. | 糖类、油脂及蛋白质都含有C、H、O元素 | |
| D. | 酸雨浸蚀的土壤中加入熟石灰,可对该土壤进行修复 |
4.用海水制盐工业中的母液来生产金属镁的一种工艺流程如下:
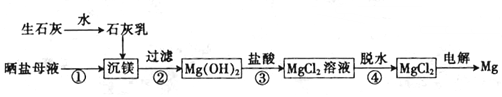
下列说法错误的是( )

下列说法错误的是( )
| A. | 上述工艺流程中未涉及置换反应 | |
| B. | 设计步骤①、②、③的主要目的是富集MgCl2 | |
| C. | 脱水时在HCl气氛中进行可防止MgCl2发生水解 | |
| D. | 电解得到的炽热镁粉可在二氧化碳气氛中冷却 |
5.某工厂对工业污泥中的Cr元素回收与再利用的工艺如图(已知硫酸浸取液中的金属离子主要是Cr3+,其次是少量的Fe2+、Fe3+、Al3+、Ca2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见表:
(1)实验室用98%(密度为1.84g•cm-3)的浓硫酸配制200mL 4.8mol•L-1的硫酸溶液,配制时需要量取98%的浓硫酸的体积为52.2 mL(保留小数点后一位小数),所用的玻璃仪器除烧杯、玻璃棒、量筒和酸式滴定管外,还需200mL容量瓶,胶头滴管.
(2)过滤操作时,需要对沉淀进行洗涤,洗漆沉淀的方法是沿玻璃棒向漏斗中注入蒸馏水,至刚好浸没沉淀物,等蒸馏水自然流尽后,再重复操作2到3次.
(3)加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr(CrO42-或Cr2O72-),以便于与杂质离子分离:另一方面是2Fe2++H2O2+2H+=2Fe3++2H2O.(离子方程式表示)
(4)调节溶液的pH=8除去的杂质离子是Al3+、Fe3+.
(5)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是Ca2+、Mg2+.
(6)通SO2气体时,还原过程发生以下反应(填写缺项物质并配平):
Na2Cr2O7+3SO2+11H2O=2Cr(OH)(H2O)5SO4+1Na2SO4.

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 9(>9溶解) |
(2)过滤操作时,需要对沉淀进行洗涤,洗漆沉淀的方法是沿玻璃棒向漏斗中注入蒸馏水,至刚好浸没沉淀物,等蒸馏水自然流尽后,再重复操作2到3次.
(3)加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr(CrO42-或Cr2O72-),以便于与杂质离子分离:另一方面是2Fe2++H2O2+2H+=2Fe3++2H2O.(离子方程式表示)
(4)调节溶液的pH=8除去的杂质离子是Al3+、Fe3+.
(5)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是Ca2+、Mg2+.
(6)通SO2气体时,还原过程发生以下反应(填写缺项物质并配平):
Na2Cr2O7+3SO2+11H2O=2Cr(OH)(H2O)5SO4+1Na2SO4.
2.有关氧化还原反应的叙述正确的是( )
| A. | 有单质参加或有单质生成的化学反应一定是氧化还原反应 | |
| B. | 有单质生成的分解反应属于氧化还原反应 | |
| C. | 没有单质参加的化合反应一定是非氧化还原反应 | |
| D. | 氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原 |
 已知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似,如图,则硼氮苯的二氯取代物B2N3H4Cl2的同分异构的数目为( )
已知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似,如图,则硼氮苯的二氯取代物B2N3H4Cl2的同分异构的数目为( ) ;溴化钠中存在的化学键是离子键,
;溴化钠中存在的化学键是离子键, ,溴化钠的电离方程式为NaBr=Na++Br-.检验某固体试样中是否有Br-的方法为取固体试样少许用蒸馏水溶解,再滴加硝酸酸化的硝酸银溶液,若有浅黄色沉淀生成,则证实有Br-存在.
,溴化钠的电离方程式为NaBr=Na++Br-.检验某固体试样中是否有Br-的方法为取固体试样少许用蒸馏水溶解,再滴加硝酸酸化的硝酸银溶液,若有浅黄色沉淀生成,则证实有Br-存在.