题目内容
7.下列各组物质相互混合反应后,最终有白色沉淀生成的是( )①金属钠投入到FeCl2溶液中
②过量NaOH溶液和明矾溶液混合
③少量Ca(OH)2投入过量NaHCO3溶液中
④向NaAlO2溶液中滴入少量盐酸
⑤向饱和Na2CO3通入足量CO2.
| A. | ①③④⑤ | B. | 只有①④ | C. | 只有②③ | D. | 只有③④⑤ |
分析 ①钠和水反应生成的氢氧化钠和FeCl2溶液发生复分解反应生成Fe(OH)2,氢氧化亚铁被氧化生成氢氧化铁红褐色沉淀;
②量NaOH溶液和明矾溶液混合反应生成偏铝酸钠;
③少量Ca(OH)2投入过量NaHCO3溶液中发生复分解反应有碳酸钙是白色沉淀生成;
④向NaAlO2溶液中滴入少量盐酸生成氢氧化铝沉淀;
⑤碳酸钠溶解度大于碳酸氢钠.
解答 解:①金属钠投入到烧杯中的FeCl2溶液中,发生的反应为:2Na+2H2O=2NaOH+H2 ↑,2NaOH+FeCl2=Fe(OH)2 ↓+2NaCl,4Fe(OH)2+O2+2H2O=4Fe(OH)3,所以最终生成的沉淀是红褐色的,所以不符合,故错误;
②过量NaOH溶液和明矾溶液混合,发生的反应是:3OH+Al3+=Al(OH)3↓,AlOH3+OH-=AlO2-+2H2O,所以最终没有沉淀生成,故错误;
③少量Ca(OH)2投入过量NaHCO3溶液中发生的反应为:Ca(OH)2+NaHCO3=CaCO3 ↓+H2O+NaOH,碳酸钙是白色沉淀,所以有白色沉淀生成,故正确;
④向NaAlO2溶液中滴入少量盐酸发生的反应为:AlO2-+H++H2O=Al(OH)3↓,氢氧化铝是白色沉淀,故正确;
⑤向饱和Na2CO3溶液中通入足量CO2发生的反应为:Na2CO3+H2O+CO2=2NaHCO3,碳酸氢钠的溶解性小于碳酸钠的溶解性,所以向饱和Na2CO3溶液中通入足量CO2会析出碳酸氢钠晶体,所以产生白色沉淀,故正确.
故选D.
点评 本题综合考查元素化合物知识,为高考常见题型,侧重于元素化合物知识的综合理解和运用的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大,注意把握与量有关的反应.

练习册系列答案
相关题目
17.完成下表的空白
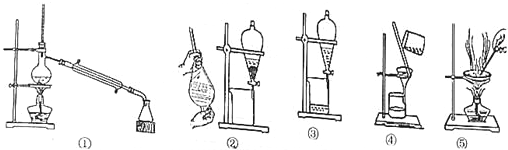

| 操作名称 | 适用对象或利用的物理性质 | 装置仪器 | 典型示例 |
| 过滤 | 除去江水中的泥沙 | ||
| 从食盐中获取NaCl晶体 | |||
| 将CCl4与水分离开 | |||
| ② | |||
| 蒸馏 | 从海水中获取淡水;工业上提纯酒精 |
18.下列化学方程式或离子方程式正确的是( )
| A. | 1一氯丙烷中加入氢氧化钠溶液并加热:CH3CH2CH2Cl+NaOH $→_{△}^{水}$CH3CH=CH2↑+NaCl+H2O | |
| B. | 苯酚钠溶液中通入少量二氧化碳:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| C. | 甲醛溶液中加入足量新制碱性Cu(OH)2悬浊液并加热HCHO+2 Cu(OH)2+OH-$\stackrel{△}{→}$ HCOO-+Cu2O↓+3H2O | |
| D. | 向小苏打溶液中加入醋酸:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO- |
15.水溶液中的行为是中学化学的重要内容.
(1)25℃时,某溶液中由水电离出c(H+)=1×10-10 mol/L,该溶液pH为4或10.
(2)25℃时,测得亚硫酸氢钠溶液的pH<7,解释该溶液显酸性的原因(用离子方程式表示,并作适当解释)HSO3-+H2O?H2SO3+OH-HSO3-?H++SO32-,且电离程度大于水解程度,故溶液显酸性.
(3)电离常数是衡量弱电解质电离程度强弱的物理量.已知:
25℃时,将浓度相同的四种盐溶液:①NaCN ②NaClO ③Na2CO3 ④NaHCO3,按pH由大到小的顺序排列③>①>②>④(填序号),向84消毒液中通入少量的CO2,该反应的化学方程式为NaClO+CO2+H2O=NaHCO3+HClO.
(4)25℃时,将n mol•L-1的氨水与0.2mol•L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显中性(填“酸”、“碱”或“中”),NH3•H2O的电离常数Kb=$\frac{2×1{0}^{-8}}{n-0.2}$(用含n的代数式表示).
(1)25℃时,某溶液中由水电离出c(H+)=1×10-10 mol/L,该溶液pH为4或10.
(2)25℃时,测得亚硫酸氢钠溶液的pH<7,解释该溶液显酸性的原因(用离子方程式表示,并作适当解释)HSO3-+H2O?H2SO3+OH-HSO3-?H++SO32-,且电离程度大于水解程度,故溶液显酸性.
(3)电离常数是衡量弱电解质电离程度强弱的物理量.已知:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| HClO | K=3×10-8 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
(4)25℃时,将n mol•L-1的氨水与0.2mol•L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显中性(填“酸”、“碱”或“中”),NH3•H2O的电离常数Kb=$\frac{2×1{0}^{-8}}{n-0.2}$(用含n的代数式表示).
2.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁均有水珠 | 两种物质均受热分解 |
| B | 将铜粉加入1.0mol/L Fe2(SO4)3溶液中 | 溶液变蓝,有黑色固体出现 | 金属铁比铜活泼 |
| C | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点较低 |
| D | 向FeSO4溶液中先滴入KSCN溶液,再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+有还原性 |
| A. | A | B. | B | C. | C | D. | D |
12.在学习了溶液中的离子反应之后,小明同学认为反应中的先后顺序很重要,他们归纳了下面一些情况,在他所作的整理中,你认为正确的是( )
| A. | 向浓度为0.1 mol/L 的FeCl3和CuCl2混合溶液加入铁粉,CuCl2首先反应 | |
| B. | 向(NH4)2Fe(SO4)2溶液中滴加少量的NaOH溶液,NH4+先反应 | |
| C. | 向浓度均为0.1 mol/L的Na2CO3和NaOH混合溶液通入CO2气体,NaOH先反应 | |
| D. | 向浓度均为0.1 mol/L的FeBr2通入少量氯气,Br-首先反应 |
2.下列说法中错误的是( )
| A. | 在豆浆里加入盐卤做豆腐,在河流入海处易形成沙洲都与胶体性质有关 | |
| B. | 淀粉胶体中混有的氯化钠可以通过渗析的方法除去 | |
| C. | 一束平行光线射入蛋白质溶液里,从侧面可以看到一条光亮的通路 | |
| D. | Fe(OH)3悬浊液和Fe(OH)3胶体都不稳定,都不能透过滤纸 |
19.下列说法正确的是( )
| A. | 金刚石和石墨互为同位素 | |
| B. | C2H6和C5H12互为同系物 | |
| C. | C2H4和C2H6互为同系物 | |
| D. | CH3CH2CH2CH3和CH3CH(CH3)2互为同系物 |
20.在恒温恒容下,可以证明CO2(g)+3H2(g)?CH3OH(g)+H2O(g)已达平衡状态的是( )
| A. | 3v正(H2)=v逆(CH3OH) | B. | 混合气体的密度不再改变 | ||
| C. | 容器内压强不再改变 | D. | 此反应的平衡常数不再改变 |