题目内容
3.原电池装置如图所示,下列有关叙述正确的是( )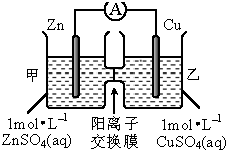
| A. | 锌电极上发生还原反应 | |
| B. | 电池工作一段时间后,甲池的c(SO42-)不变 | |
| C. | 电池工作一段时间后,甲池溶液的总质量增加 | |
| D. | 该装置将化学能转化为电能,一段时间后,装置内的电子总量减少 |
分析 锌为负极,被氧化,电极反应为Zn-2e-=Zn2+,铜为正极,发生还原反应,电极反应为Cu2++2e-=Cu,结合电极反应解答.
解答 解:A.锌为负极,被氧化,发生氧化反应,故A错误;
B.锌为负极,电极反应为Zn-2e-=Zn2+,因为中间为阳离子交换膜,所以生成的锌离子移向乙池,则甲池的c(SO42-)不变,故B正确;
C.甲池锌为负极,电极反应为Zn-2e-=Zn2+,因为中间为阳离子交换膜,所以生成的锌离子移向乙池,则甲池溶液的总质量减小,故C错误;
D.该装置为原电池,将化学能转化为电能,一段时间后,装置内的电子总量不变,故D错误.
故选B.
点评 本题考查原电池知识,侧重于原电池的工作原理的考查,为高考高频考点,注意把握电极反应的判断,把握电极方程式的书写,为解答该类题目的关键,难度不大.

练习册系列答案
相关题目
13.构建和谐社会的总要求之一是人与自然和谐相处,下列做法不符合这一主题的是( )
| A. | 中科院广州化学所在利用二氧化碳制取可降解塑料的技术方面处于世界领先水平,该技术的成功应用将有效改善以二氧化碳为主的温室气体引发的“厄尔尼诺”、“拉尼娜”等全球气候异常现象 | |
| B. | 许多国家对聚乙烯等塑料垃圾进行了深埋或者倾倒入海处理,达到消除“白色污染”的目的 | |
| C. | 山东单县采用以杂草、秸秆等为原料的生物质发电,有效地减少了二氧化硫的排放 | |
| D. | 汽油中掺入酒精使用,可以降低对环境的污染和节约能源 |
14.下列说法正确的是( )
| A. | KW随温度、浓度的改变而改变 | |
| B. | 凡是能自发进行的化学反应,一定是△H<0、△S>0 | |
| C. | 对已达到化学平衡的反应,改变压强,平衡常数(K)一定改变 | |
| D. | Ksp与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
11.用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是( )
| 选 项 | 操作及现象 | 溶 液 |
| A | 加入NaOH,溶液产生蓝色沉淀.再加入葡萄糖,加热,产生红色沉淀. | CuSO4溶液 |
| B | 加入NaOH,溶液产生白色沉淀.再通入CO2,白色沉淀消失. | Ca(HCO3)2溶液 |
| C | 加入NaOH,溶液紫色褪去.再加入盐酸,振荡,溶液又变成紫色. | I2的CCl4溶液 |
| D | 加入NaOH,溶液产生白色沉淀,有刺激性气味气体产生.继续加入 NaOH,沉淀消失. | KAl(SO4)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
18.下列反应发生时,会产生棕黄色烟的是( )
| A. | 金属钠在C12中燃烧 | B. | 铜在氯气中燃烧 | ||
| C. | 氢气在氯气中燃烧 | D. | 钠在氧气中燃烧 |
8.已知299K时,合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.0kJ/mol,将此温度下的1mol N2和3mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)( )
| A. | 一定小于92.0 kJ | B. | 一定等于92.0 kJ | C. | 一定大于92.0 kJ | D. | 不能确定 |
15.下列实验现象描述正确的是( )
| A. | 钠在氧气中燃烧火焰呈白色,生成淡黄色固体 | |
| B. | 铁与稀硫酸反应,产生大量的气体,生成棕黄色溶液 | |
| C. | 铜与氯气反应产生棕黄色的烟,加少量水后溶液呈蓝绿色 | |
| D. | 氢气在氯气中燃烧产生苍白色烟雾,生成有刺激性气味的气体 |
12.下列有关生活和生产中化学知识的描述正确的是( )
| A. | 高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路” | |
| B. | 侯氏制碱法的工艺原理主要应用了物质熔沸点的差异 | |
| C. | 铝合金的大量使用归功于人们能使用焦炭等还原剂从氧化铝中获得铝 | |
| D. | 用蘸有浓氨水的玻璃棒检验输送氯气的管道是否漏气 |