题目内容
如图为某同学设计的验证质量为25g的银元(银和铜的合金)完全溶解于一定量的浓硝酸后生成NO2气体中含有NO的实验装置图,并测定中银元中银的质量分数.
已知:常温时,NO2与N2O4同时存在;在低于0℃时,几乎只有无色的N2O4的晶体存在.
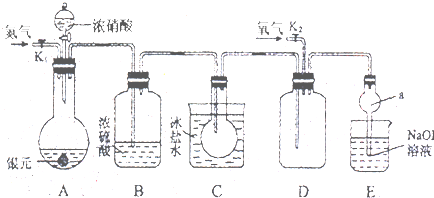
(1)反应前先打开A中的活塞K1,持续通一段时间N2,其理由是 ;
(2)若装置中缺B,其后果是 .
(3)反应结束后,打开D中的活塞K2,并通入氧气,银铜合金完全溶解于浓硝酸后生成的NO2气体中含有NO的现象为: ,化学反应方程式为: .
(4)C装置的作用是 ;E中a仪器所起的作用是 ;
(5)若该同学将A中完全反应后的溶液倒入烧杯…,通过生成AgCl沉淀的方法,确定该银元中银的质量分数,其实验方案和操作为: .
已知:常温时,NO2与N2O4同时存在;在低于0℃时,几乎只有无色的N2O4的晶体存在.

(1)反应前先打开A中的活塞K1,持续通一段时间N2,其理由是
(2)若装置中缺B,其后果是
(3)反应结束后,打开D中的活塞K2,并通入氧气,银铜合金完全溶解于浓硝酸后生成的NO2气体中含有NO的现象为:
(4)C装置的作用是
(5)若该同学将A中完全反应后的溶液倒入烧杯…,通过生成AgCl沉淀的方法,确定该银元中银的质量分数,其实验方案和操作为:
考点:性质实验方案的设计,硝酸的化学性质
专题:实验题
分析:(1)装置内的空气中含有氧气,能和NO反应生成二氧化氮而造成干扰;
(2)二氧化氮或四氧化二氮和水反应生成NO而造成干扰;
(3)NO被氧气氧化生成红棕色气体二氧化氮;
(4)把NO2全部转化为N2O4晶体,防止二氧化氮干扰NO的检验;后缓冲装置的能防止倒吸;
(5)将银离子转化为AgCl沉淀,然后进行过滤、洗涤、烘干和测量,从而测定测定溶液中Ag+的质量.
(2)二氧化氮或四氧化二氮和水反应生成NO而造成干扰;
(3)NO被氧气氧化生成红棕色气体二氧化氮;
(4)把NO2全部转化为N2O4晶体,防止二氧化氮干扰NO的检验;后缓冲装置的能防止倒吸;
(5)将银离子转化为AgCl沉淀,然后进行过滤、洗涤、烘干和测量,从而测定测定溶液中Ag+的质量.
解答:
解:(1)空气中含有氧气,将生成的NO转化为二氧化氮而对实验造成干扰,为防止NO被氧化,所以先通入氮气排出空气,
故答案为:排除装置内的空气,防止生成的NO被空气中的O2氧化;
(2)若装置中缺B,A中挥发出的水蒸气在C中生成液态水,导致二氧化氮或四氧化二氮和水反应生成NO而干扰实验,为排出水蒸气的影响,用浓硫酸干燥气体,
故答案为:C中水蒸气被冷却成水,它与NO2或N2O4反应生成NO,干扰NO的验证;
(3)NO被氧气氧化生成红棕色气体二氧化氮,反应方程式为2NO+O2=2NO2,
二氧化氮转化为四氧化二氮的反应是放热反应,升高温度,平衡向生成二氧化氮的方向移动,导致气体颜色变深,
故答案为:D瓶内气体由无色变为红棕色;2NO+O2=2NO2;
(4)降低温度,将二氧化氮完全转化为N2O4晶体,防止二氧化氮对NO检验的干扰;该装置后缓冲作用,防止倒吸,
故答案为:把NO2全部转化为N2O4晶体,避免在D装置中对NO的验证产生干扰;防止倒吸;
(5)将银离子转化为AgCl沉淀,然后进行过滤、洗涤、烘干和测量,从而测定测定溶液中Ag+的质量,所以实验方案和操作为:用蒸馏水洗涤烧杯2-3次,将洗涤液倒入烧杯,然后加入过量的NaCl溶液,过滤、洗涤、烘干、称量AgCl,计算Ag的质量及质量分数,
故答案为:用蒸馏水洗涤烧杯2-3次,将洗涤液倒入烧杯,然后加入过量的NaCl溶液,过滤、洗涤、烘干、称量AgCl,计算Ag的质量及质量分数.
故答案为:排除装置内的空气,防止生成的NO被空气中的O2氧化;
(2)若装置中缺B,A中挥发出的水蒸气在C中生成液态水,导致二氧化氮或四氧化二氮和水反应生成NO而干扰实验,为排出水蒸气的影响,用浓硫酸干燥气体,
故答案为:C中水蒸气被冷却成水,它与NO2或N2O4反应生成NO,干扰NO的验证;
(3)NO被氧气氧化生成红棕色气体二氧化氮,反应方程式为2NO+O2=2NO2,
二氧化氮转化为四氧化二氮的反应是放热反应,升高温度,平衡向生成二氧化氮的方向移动,导致气体颜色变深,
故答案为:D瓶内气体由无色变为红棕色;2NO+O2=2NO2;
(4)降低温度,将二氧化氮完全转化为N2O4晶体,防止二氧化氮对NO检验的干扰;该装置后缓冲作用,防止倒吸,
故答案为:把NO2全部转化为N2O4晶体,避免在D装置中对NO的验证产生干扰;防止倒吸;
(5)将银离子转化为AgCl沉淀,然后进行过滤、洗涤、烘干和测量,从而测定测定溶液中Ag+的质量,所以实验方案和操作为:用蒸馏水洗涤烧杯2-3次,将洗涤液倒入烧杯,然后加入过量的NaCl溶液,过滤、洗涤、烘干、称量AgCl,计算Ag的质量及质量分数,
故答案为:用蒸馏水洗涤烧杯2-3次,将洗涤液倒入烧杯,然后加入过量的NaCl溶液,过滤、洗涤、烘干、称量AgCl,计算Ag的质量及质量分数.
点评:本题以银和硝酸反应为载体考查实验探究,题目难度中等,明确NO和二氧化氮性质是解本题关键,再结合化学平衡分析解答,知道明确实验操作顺序及各仪器的作用,试题充分考查了学生的分析、理解能力及综合应用所学知识能力.

练习册系列答案
相关题目
某溶液只含有Na+,Al3+,Cl-,SO42-四种离子,已知Na+,Al3+,Cl-的个数比为3:2:1.则溶液中Al3+与SO42-离子的个数比为( )
| A、1:2 | B、1:4 |
| C、3:4 | D、3:2 |
标准状况下,某气体A的密度是氢气密度的22倍,则下列说法正确的是(已知NA表示阿伏加德罗常数的数值)( )
| A、该气体的相对分子质量是44 |
| B、该气体的体积是22.4L |
| C、该气体的质量是44G |
| D、该气体的原子数是3NA |
下列关于物质的分类说法正确的是( )
| A、CO2、SO2、CO都是酸性氧化物 |
| B、酒精、烧碱、冰醋酸都是电解质 |
| C、雾、稀豆浆、氯化铁溶液都是胶体 |
| D、氨水、空气、漂白粉都是混合物 |
常温下,下列各组离子在指定溶液中可能大量存在的( )
| A、由水电离出来的c(H+)=10-12 mol?L-1的溶液中:Cl-、CO32-、K+、SO32- |
| B、含有大量AlO2-的溶液中:K+、Al3+、Br-、HCO3- |
| C、使甲基橙变红的溶液中:Fe2+、K+、NO3-、SO42- |
| D、使pH试纸变深蓝色的溶液中:Cl-、K+、Mg2+、SO32- |
 CuCl是应用广泛的有机合成催化剂,也在染料工业中用作实效型气体吸收剂.利用废旧印刷电路板制氯化亚铜可减少污染、实现资源再生.请回答下列问题:
CuCl是应用广泛的有机合成催化剂,也在染料工业中用作实效型气体吸收剂.利用废旧印刷电路板制氯化亚铜可减少污染、实现资源再生.请回答下列问题: