题目内容
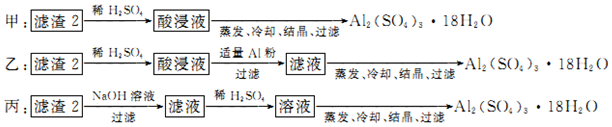
19.关于如图装置(X、Y均为石墨)的下列说法正确的是( )
| A. | 电极X上发生氧化反应 | |
| B. | 电极Y上有气体产生 | |
| C. | 接通电路时,电子从电源的负极流出经过溶液后再从正极流 回电源 | |
| D. | 若反应中有0.1mol电子转移则阴极产物的质量为3.2g |
分析 A.连接电源负极的为阴极;
B.电极Y为阳极,发生的电极反应方程式为2Cl--2e-=Cl2↑;
C.电子流行负极→阴极→溶液→阳极→正极;
D.阴极发生的电极反应方程式为Cu2++2e-=Cu,据此进行计算.
解答 解:A.连接电源负极的为阴极,阴极发生还原反应,故A错误;
B.电极Y为阳极,发生的电极反应方程式为2Cl--2e-=Cl2↑,故电极Y上有气体产生,故B正确;
C.电子流行负极→阴极→溶液→阳极→正极,故C错误;
D.阴极发生的电极反应方程式为Cu2++2e-=Cu,
2 64
0.1 3.2,故阴极产物的质量为3.2g,故D正确,
故选BD.
点评 本题考查了电解池的反应原理的应用,电子流向、电极判断,阴极质量的变化,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.图是某酸性酒精检测仪的工作示意图.下列有关分析正确的是( )


| A. | 该检测仪利用了电解原理 | |
| B. | 质子交换膜具有类似盐桥的平衡电荷作用 | |
| C. | Pt(l)极反应为:CH3CH2OH-4e-+H2O=4H++CH3COOH | |
| D. | 工作中电子由Pt(l)电极经过质子交换膜流向Pt(II) |
10.下列各种叙述中正确的是( )
| A. | 在CH2=CH2分子中,存在4个σ键和一个π键 | |
| B. | 在共价化合物中,一定存在极性键,可能存在非极性键,一定不存在离子键 | |
| C. | N、O、F电负性大小:F>O>N;第一电离能大小:F>O>N | |
| D. | 酸性强弱:H2SO4>H2SO3>H2SeO3;岩浆晶出的先后顺序:SiO2、MgSiO3、CaSiO3 |
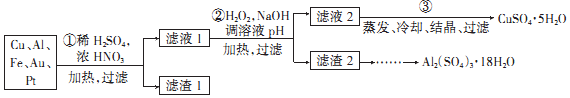
14. 利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液可吸收NO2.下列说法正确的是( )
利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液可吸收NO2.下列说法正确的是( )
 利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液可吸收NO2.下列说法正确的是( )
利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液可吸收NO2.下列说法正确的是( )| A. | a为直流电源的负极 | |
| B. | 与 b电极相连的电极反应式为:2HSO3-+2H++2e-═S2O42-+2H2O | |
| C. | 与 a相连的电极发生还原反应得到SO42- | |
| D. | 电解时,H+由阴极室通过阳离子交换膜到阳极室 |
4.证明溴乙烷中溴元素的存在,下列操作步骤中正确的是
①加入硝酸银溶液 ②加入氢氧化钠溶液 ③加热④加入蒸馏水 ⑤加入稀硝酸至溶液呈酸性 ⑥加入氢氧化钠醇溶液( )
①加入硝酸银溶液 ②加入氢氧化钠溶液 ③加热④加入蒸馏水 ⑤加入稀硝酸至溶液呈酸性 ⑥加入氢氧化钠醇溶液( )
| A. | ④③①⑤ | B. | ②③⑤① | C. | ④⑥③① | D. | ④⑤⑥③ |
11. 乙酸橙花酯兼有橙花和玫瑰花香气,其结构简式如图.关于该有机物的叙述中正确的是
乙酸橙花酯兼有橙花和玫瑰花香气,其结构简式如图.关于该有机物的叙述中正确的是
①在Ni催化条件下1mol该有机物可与3mol H2发生加成;
②该有机物不能发生银镜反应;
③该有机物分子式为C12H22O2;
④该有机物的同分异构体中不可能有酚类;
⑤1mol该有机物水解时只能消耗1mol NaOH( )
 乙酸橙花酯兼有橙花和玫瑰花香气,其结构简式如图.关于该有机物的叙述中正确的是
乙酸橙花酯兼有橙花和玫瑰花香气,其结构简式如图.关于该有机物的叙述中正确的是①在Ni催化条件下1mol该有机物可与3mol H2发生加成;
②该有机物不能发生银镜反应;
③该有机物分子式为C12H22O2;
④该有机物的同分异构体中不可能有酚类;
⑤1mol该有机物水解时只能消耗1mol NaOH( )
| A. | ②④⑤ | B. | ①④⑤ | C. | ②③⑤ | D. | ①②③ |
8.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | 0.1 mol丙烯酸(CH2=CHCOOH)中含有碳原子的数目为0.2NA | |
| C. | 标准状况下,11.2LCCl4中含有分子的数目为0.5NA | |
| D. | 在2Na2O2+2H2O═4NaOH+O2↑的反应中,每生成0.1 mol氧气,转移电子的数目为0.1NA |
9.下列叙述正确的有( )
| A. | 某元素原子核外电子总数是最外层电子数的5倍,则其最高正价为+7 | |
| B. | 钠元素的第一、第二电离能分别小于镁元素的第一、第二电离能 | |
| C. | 高氯酸的酸性与氧化性均大于次氯酸的酸性和氧化性 | |
| D. | 邻羟基苯甲醛的熔点低于对羟基苯甲醛的熔点 |