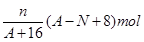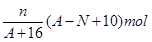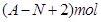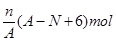题目内容
几种短周期元素的原子半径及主要化合价见下表:
下列说法正确的是
A.L、Q形成的简单离子核外电子数相等
B.L、R的单质与盐酸反应速率为R>L
C.Q、T两元素的氢化物的稳定性为HnT<HnQ
D.M与T形成的化合物能与NaOH溶液反应
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
A.L、Q形成的简单离子核外电子数相等
B.L、R的单质与盐酸反应速率为R>L
C.Q、T两元素的氢化物的稳定性为HnT<HnQ
D.M与T形成的化合物能与NaOH溶液反应
D
试题分析:短周期元素,由元素的化合价可知,T只有-2价,则T为O元素,可知Q为S元素,L、M、R只有正价,原子半径L>R,则L为Mg元素,R为Be元素,原子半径M的介于L、Q之间,则M为Al元素。
A中L2+的核外电子数为12-2=10,Q2-的核外电子数为16-(-2)=18,不相等,A不正确;
B中金属性Mg比Be强,则Mg与酸反应越剧烈,则相同条件下单质与稀盐酸反应速率为L>R,故B不正确;
C中H2Q为H2S,H2T为H2O,非金属性越强,氢化物的稳定性越强。非金属是氧元素强于S元素,则稳定性是H2O>H2S,即H2Q<H2T,故C错误;
D中M与T形成的化合物是氧化铝,是两性氧化物,能溶于氢氧化钠溶液中,D正确,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题难易适中,基础性强。能利用原子半径及化合价来推断出元素是解答本题的关键,并熟悉元素及其单质、化合物的性质来解答即可,有利于培养学生的逻辑推理能力和逆向思维能力。

练习册系列答案
 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目