题目内容
1.下列实验方法能达到实验目的是( )| A. | 用分液漏斗从食醋中分离出乙酸 | |
| B. | 用硫氰化钾溶液检验FeCl2溶液是否变质 | |
| C. | 用氢氧化钠溶液除去Cl2中含有的少量HCl | |
| D. | 用硝酸银溶液鉴别Na2SO4和Na2CO3 |
分析 A.乙酸易溶于水,混合液不分层,无法通过分液分离出乙酸;
B.铁离子能够使硫氰化钾溶液变红;
C.氯气和氯化氢都能够与氢氧化钠溶液反应;
D.硫酸钠和碳酸钠都能够与硝酸银溶液反应生成白色沉淀.
解答 解:A.食醋不分层,无法用分液漏斗从食醋中分离出乙酸,故A错误;
B.铁离子能使硫氰化钾溶液变红,而亚铁离子不能,可用硫氰化钾溶液检验FeCl2溶液是否变质,故B正确;
C.HCl和氯气都能够与NaOH溶液反应,不能用氢氧化钠溶液除去Cl2中含有的少量HCl,可用饱和食盐水,故C错误;
D.Na2SO4和Na2CO3都与硝酸银溶液生成白色沉淀,不能用用硝酸银溶液鉴别Na2SO4和Na2CO3,故D错误;
故选B.
点评 本题考查化学实验方案的评价,题目难度不大,涉及物质分离与提纯、常见物质鉴别、离子检验等知识,明确常见元素及其化合物性质为解答关键,注意掌握常见化学实验基本操作方法,试题培养了学生的化学实验能力.

练习册系列答案
相关题目
17.密闭高炉中发生反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-24.73kJ•mol-1,若其他条件不变,下列措施能使平衡逆向移动的是( )
| A. | 增大CO的投加量 | B. | 升高温度 | C. | 及时排出CO2 | D. | 加入催化剂 |
12.下列用水就能鉴别的一组物质是( )
| A. | 苯、己烷、四氯化碳 | B. | 甲苯、酒精、四氯化碳 | ||
| C. | 硝基苯、酒精、四氯化碳 | D. | 溴苯、酒精、醋酸 |
9.下列说法正确的是( )
| A. | 干冰升华时要吸收热量,所以这是吸热反应 | |
| B. | 浓硫酸可用来干燥SO2、CO、Cl2等气体 | |
| C. | 浓硫酸具有强氧化性,常温下不可用铝罐盛装 | |
| D. | 二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性 |
16.在下列变化中需加入还原剂才能实现的是( )
| A. | KClO3→HCl | B. | Na2O2→O2 | C. | Fe Cl3→FeCl2 | D. | SO2→SO3 |
6.一定条件下,容积为1L的密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g),下列各项中不能说明该反应已达化学平衡状态的是( )
| A. | 消耗2 mol SO2的同时生成1 mol O2 | |
| B. | 容器内气体总物质的量不再变化 | |
| C. | 反应平衡常数保持不变 | |
| D. | SO3的气体体积分数不再变化 |
18.下列叙述正确的是( )
| A. | 加热能够抑制水的电离 | |
| B. | 金属发生吸氧腐蚀时,被腐蚀的速率和氧气浓度无关 | |
| C. | 原电池中发生的反应达到平衡时,该电池仍有电流产生 | |
| D. | 在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小 |
19.图中,R、W、X、Y、Z为元素周期表中前四周期的部分元素,下列有关叙述正确的是( )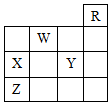

| A. | 五种元素中,只有Z为金属元素 | |
| B. | W位于ⅥA族,有+6、-2两种常见化合价 | |
| C. | X和Y的最高价氧化物对应水化物都是强酸 | |
| D. | X、Y、Z的气态氢化物的稳定性:Y>X>Z |

 .
.