题目内容
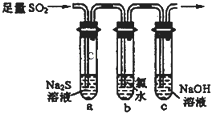 二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义.
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义.(1)工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2:
4FeS2+1102
| ||
(2)一化学研究性学习小组设计用如下装置验证二氧化硫的化学性质.
①能说明二氧化硫具有氧化性的实验现象为
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀.
上述方案合理的是方案
考点:二氧化硫的化学性质
专题:氧族元素
分析:(1)氧化还原反应中,化合价升高的元素在反应中被氧化;
(2)①二氧化硫具有氧化性,可以和最低价的硫化钠发生氧化还原反应;
②氯气具有氧化性,可以将二氧化硫氧化到最高价的硫酸.
(2)①二氧化硫具有氧化性,可以和最低价的硫化钠发生氧化还原反应;
②氯气具有氧化性,可以将二氧化硫氧化到最高价的硫酸.
解答:
解:(1)4FeS2+1102
8SO2+2Fe2O3中,化合价升高的Fe、S元素在反应中被氧化,故答案为:Fe、S;
(2)①二氧化硫具有氧化性,可以和最低价的硫化钠发生氧化还原反应,生成淡黄色的沉淀S,故答案为:试管a中出现淡黄色浑浊;
②方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成,可能是氯水中的氯离子产生的作用,
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去,可以是氯水中含有的漂白性物质次氯酸起的作用;
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀,证明溶液中含硫酸根离子,是二氧化硫在酸性环境下被氯水氧化生成的,即SO2+Cl2+2H2O=4H++SO42-+2Cl-,S元素的化合价升高,体现二氧化硫的还原性,则实验设计合理,
故答案为:Ⅲ;SO2+Cl2+2H2O=4H++SO42-+2Cl-.
| ||
(2)①二氧化硫具有氧化性,可以和最低价的硫化钠发生氧化还原反应,生成淡黄色的沉淀S,故答案为:试管a中出现淡黄色浑浊;
②方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成,可能是氯水中的氯离子产生的作用,
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去,可以是氯水中含有的漂白性物质次氯酸起的作用;
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀,证明溶液中含硫酸根离子,是二氧化硫在酸性环境下被氯水氧化生成的,即SO2+Cl2+2H2O=4H++SO42-+2Cl-,S元素的化合价升高,体现二氧化硫的还原性,则实验设计合理,
故答案为:Ⅲ;SO2+Cl2+2H2O=4H++SO42-+2Cl-.
点评:本题考查二氧化硫的性质及实验设计,为高频考点,把握反应中元素的化合价变化及(2)中实验目的为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
下列关于铝的叙述中,正确的是( )
| A、铝是地壳里含量最多的元素 |
| B、铝是热和电的良导体 |
| C、铝能溶解于冷的浓硝酸中,氧化生成硝酸铝 |
| D、铝硅合金的熔点比纯硅或铝的熔点低 |
化学真正成为一门科学并较快发展,始于( )
| A、舍勒发现氧气 |
| B、质量守恒定律的发现 |
| C、原子-分子论的问世 |
| D、中国湿法冶金术的推广 |
下列各组混合物能用分液漏斗分离的是( )
| A、硝基苯和苯 | B、甲苯和水 |
| C、溴苯和液溴 | D、甘油和乙醇 |

 CO2、SO2、NOx 是对环境影响较大的气体,控制和治理CO2、SO2、NOx 是解决温室效应、减少酸雨和光化学烟雾的有效途径.
CO2、SO2、NOx 是对环境影响较大的气体,控制和治理CO2、SO2、NOx 是解决温室效应、减少酸雨和光化学烟雾的有效途径.