题目内容
在2CH4(g)+2NH3(g)+3O2(g)=2HCN(g)+6H2O(g)反应中,已知v (HCN)=n mol/(L?min),且v(O2)=m mol/(L?min),则m与n的关系正确的是( )
分析:各物质的反应速率之比等于其计量数之比,据此计算判断.
解答:解:已知:v(HCN)=n mol/(L?min),v(O2)=m mol/(L?min),
反应速率之比等于其计量数之比,故n mol/(L?min):m mol/(L?min)=2:3,即m=
n,
故选:C.
反应速率之比等于其计量数之比,故n mol/(L?min):m mol/(L?min)=2:3,即m=
| 3 |
| 2 |
故选:C.
点评:本题考查化学反应速率的有关计算,难度不大,注意根据定义式理解速率之比等于其化学计量数之比.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
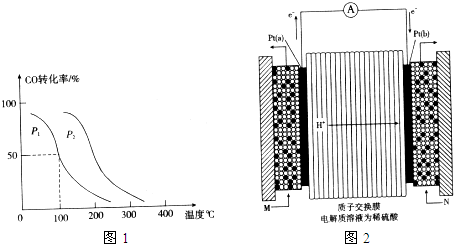
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.