题目内容
工业上常用天然气作为制备CH3OH的原料.已知:
①CH4(g)+O2(g)?CO(g)+H2(g)+H2O(g)△H=-321.5kJ/mol
②CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+250.3kJ/mol
③CO(g)+2H2(g)?CH3OH(g)△H=-90.0kJ/mol
(1)CH4(g)与O2(g)反应生成CH3OH(g)的热化学方程式为
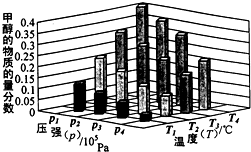
(2)向VL恒容密闭容器中充入a mol CO与2a mol H2,在不同压强下合成甲醇.CO的平衡转化率与温度、压强的关系如图1所示:

①压强P1
②在100℃、P1压强时,平衡常数为
(3)如图2所示是甲醇燃料电池(电解质溶液为稀硫酸)结构示意图,Pt(a)电极通入的M为
①CH4(g)+O2(g)?CO(g)+H2(g)+H2O(g)△H=-321.5kJ/mol
②CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+250.3kJ/mol
③CO(g)+2H2(g)?CH3OH(g)△H=-90.0kJ/mol
(1)CH4(g)与O2(g)反应生成CH3OH(g)的热化学方程式为
2CH4(g)+O2(g)=2CH3OH(g)△H=-251.2KJ/mol
2CH4(g)+O2(g)=2CH3OH(g)△H=-251.2KJ/mol
.(2)向VL恒容密闭容器中充入a mol CO与2a mol H2,在不同压强下合成甲醇.CO的平衡转化率与温度、压强的关系如图1所示:

①压强P1
<
<
P2(填“<”、“>”或“=”)②在100℃、P1压强时,平衡常数为
2×
| V2 |
| a2 |
2×
(用含a、V的代数式表示).| V2 |
| a2 |
(3)如图2所示是甲醇燃料电池(电解质溶液为稀硫酸)结构示意图,Pt(a)电极通入的M为
甲醇
甲醇
,电极反应式是CH3OH-6e-+H2O=CO2+6H+
CH3OH-6e-+H2O=CO2+6H+
.若用该电池电解CuSO4溶液,当得到3.2g铜时,参加反应的气体N的体积应为2.24
2.24
L(标准状况).分析:(1)依据热化学方程式和盖斯定律计算得到;
(2)①依据反应是气体体积减小的反应,铜温度下增大压强平衡正向进行;
②100°C时一氧化碳的转化率为50%,结合平衡三段式列式计算平衡浓度结合平衡常数概念计算得到;
(3)甲醇燃料电池中电解质溶液为稀硫酸,燃料甲醇在负极失电子发生氧化反应,正极上是氧气得到电子发生还原反应;依据电子守恒分析计算N气体的体积;
(2)①依据反应是气体体积减小的反应,铜温度下增大压强平衡正向进行;
②100°C时一氧化碳的转化率为50%,结合平衡三段式列式计算平衡浓度结合平衡常数概念计算得到;
(3)甲醇燃料电池中电解质溶液为稀硫酸,燃料甲醇在负极失电子发生氧化反应,正极上是氧气得到电子发生还原反应;依据电子守恒分析计算N气体的体积;
解答:解:(1)①CH4(g)+O2(g)?CO(g)+H2(g)+H2O(g)△H=-321.5kJ/mol
②CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+250.3kJ/mol
③CO(g)+2H2(g)?CH3OH(g)△H=-90.0kJ/mol
依据盖斯定律
①+②-2×③得到:2CH4(g)+O2(g)=2CH3OH(g)△H=-251.2KJ/mol
故答案为:2CH4(g)+O2(g)=2CH3OH(g)△H=-251.2KJ/mol
(2)①图象分析可知相同温度下P2压强下一氧化碳转化率大于P1压强下一氧化碳转化率,反应是气体体积减小的反应,压强增大平衡正向进行,所以P1<P2;
故答案为:<;
②向VL恒容密闭容器中充入a mol CO与2a mol H2,100°C时一氧化碳的转化率为50%,依据平衡三段式列式计算
CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L)
0
变化量(mol/L)
平衡量(mol/L)
平衡常数K=
=
=2×
故答案为:2×
;
(3)甲醇燃料电池中电解质溶液为稀硫酸,燃料甲醇在负极失电子发生氧化反应,电极反应为CH3OH-6e-+H2O=CO2+6H+,正极上是氧气得到电子发生还原反应,电极反应为O2+4e-+4H+=2H2O;用该电池电解CuSO4溶液,当得到3.2g铜物质的量为0.05mol时,电极反应为Cu2++2e-=Cu,依据电子守恒可知,O2~2Cu,参加反应的气体N为氧气的物质的量为0.1mol,标准状况下的体积应为2.24L;
故答案为:甲醇:2.24;
②CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+250.3kJ/mol
③CO(g)+2H2(g)?CH3OH(g)△H=-90.0kJ/mol
依据盖斯定律
①+②-2×③得到:2CH4(g)+O2(g)=2CH3OH(g)△H=-251.2KJ/mol
故答案为:2CH4(g)+O2(g)=2CH3OH(g)△H=-251.2KJ/mol
(2)①图象分析可知相同温度下P2压强下一氧化碳转化率大于P1压强下一氧化碳转化率,反应是气体体积减小的反应,压强增大平衡正向进行,所以P1<P2;
故答案为:<;
②向VL恒容密闭容器中充入a mol CO与2a mol H2,100°C时一氧化碳的转化率为50%,依据平衡三段式列式计算
CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L)
| a |
| V |
| 2a |
| V |
变化量(mol/L)
| 0.5a |
| V |
| a |
| V |
| a |
| V |
平衡量(mol/L)
| 0.5a |
| V |
| a |
| V |
| a |
| V |
平衡常数K=
| c(CH3OH) |
| c(CO)c2(H2) |
| ||||
|
| V2 |
| a2 |
故答案为:2×
| V2 |
| a2 |
(3)甲醇燃料电池中电解质溶液为稀硫酸,燃料甲醇在负极失电子发生氧化反应,电极反应为CH3OH-6e-+H2O=CO2+6H+,正极上是氧气得到电子发生还原反应,电极反应为O2+4e-+4H+=2H2O;用该电池电解CuSO4溶液,当得到3.2g铜物质的量为0.05mol时,电极反应为Cu2++2e-=Cu,依据电子守恒可知,O2~2Cu,参加反应的气体N为氧气的物质的量为0.1mol,标准状况下的体积应为2.24L;
故答案为:甲醇:2.24;
点评:本题考查了热化学方程式和盖斯定律的计算应用,化学平衡影响因素的分析判断,平衡移动原理分析应用,原电池电极反应和电解池原理的理解应用,题目难度中等.

练习册系列答案
相关题目
 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚. [Cu(NH3)3]Ac•CO(aq)(△H<0)
[Cu(NH3)3]Ac•CO(aq)(△H<0)
 的原料。已知:
的原料。已知:









 与
与 反应生成
反应生成 与
与 ,在不同压强下合成甲醇。
,在不同压强下合成甲醇。 的平衡转化率与温度、压强的关系如下图所示:
的平衡转化率与温度、压强的关系如下图所示:

 (填“<”、“>”或“=”)
(填“<”、“>”或“=”) 、
、 的代数式表示)。
的代数式表示)。 电极通入的
电极通入的 为
,电极反应式是
。
为
,电极反应式是
。
 溶液,当得到
溶液,当得到 铜时,参加反应的气体
铜时,参加反应的气体 的体积应为
的体积应为
 (标准状况)。
(标准状况)。
