题目内容
【题目】下列热化学方程式正确的是(注:![]() 的绝对值均正确)( )
的绝对值均正确)( )
A.C2H5OH(l)+3O2(g)=2CO2(g) +3H2O(g);△H= —1367.0 kJ/mol(燃烧热)
B.NaOH(aq) + HCl(aq)=NaCl(aq)+ H2O(l);△H= —57.3kJ/mol(中和热)
C.S(s) + O2(g) = SO2(g);△H= —269.8kJ/mol(反应热)
D.2HCl(g)=Cl2(g) + H2(g);△H= — 184.6kJ/mol(反应热)
【答案】BC
【解析】
燃烧热是指在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的能量,所以乙醇的燃烧产物应该是是液态水,A不正确,C正确。中和热是指在稀溶液中,酸和碱反应生成1mol水时放出的热量,B正确。D中分解反应是吸热反应,△H>0,不正确。
答案选BC。

【题目】已知25℃时,Ksp(Ag2S)=6.3×10-50、Ksp(AgCl)=1.5×10-16。某研究性学习小组探究AgCl、Ag2S沉淀转化的原因。
步骤 | 现象 |
Ⅰ.将NaCl与AgNO3溶液混合 | 产生白色沉淀 |
Ⅱ.向所得固液混合物中加Na2S溶液 | 沉淀变为黑色 |
Ⅲ.滤出黑色沉淀,加入NaCl溶液 | 在空气中放置较长时间后,沉淀变为乳白色 |
(1)Ⅰ中的白色沉淀是__。
(2)Ⅱ中能说明沉淀变黑的离子方程式是__。
(3)滤出步骤Ⅲ中乳白色沉淀,推测含有AgCl。用浓HNO3溶解,产生红棕色气体,沉淀部分溶解,过滤得到滤液X和白色沉淀Y。
ⅰ.向X中滴加Ba(NO3)2溶液,产生白色沉淀
ⅱ.向Y中滴加KI溶液,产生黄色沉淀
①由ⅰ判断,滤液X中被检出的离子是__。
②由ⅰ、ⅱ可确认步骤Ⅲ中乳白色沉淀含有AgCl和另一种沉淀__。
(4)该学生通过如下对照实验确认了步骤Ⅲ中乳白色沉淀产生的原因:在NaCl存在下,氧气将Ⅲ中黑色沉淀氧化。
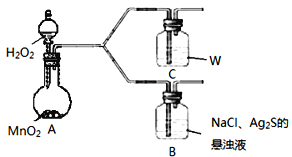
现象 | B:一段时间后,出现乳白色沉淀 |
C:一段时间后,无明显变化 |
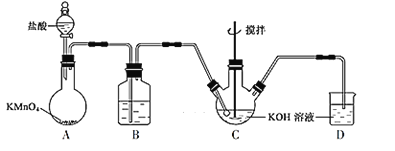
①A中产生的气体是___。
②C中盛放的物质W是__。
③该同学认为B中产生沉淀的反应如下(请补充完整):__
2Ag2S+__+__+2H2O=4AgCl+__+4NaOH
④从溶解平衡移动的角度,解释B中NaCl的作用__。