题目内容
汽车等机动车辆的启动电源常用铅蓄电池,放电时的电池反应如下:
PbO2+Pb+2H2SO4=2PbSO4+2H2O,根据此反应判断下列叙述中正确的是
| A.Pb02是电池的负极 |
| B.负极的电极反应式为:Pb+SO42--2e-=PbSO4 |
| C.PbO2得电子,被氧化 |
| D.电池放电时,溶液酸性增强 |
B
解析试题分析:A.根据电池反应式知,二氧化铅得电子发生还原反应,所以二氧化铅是正极,故A错误;B.负极上铅失电子和硫酸根离子反应生成硫酸铅,电极反应式为:Pb(s)+SO42-(aq)-2e-=PbSO4(s),故B正确;C.二氧化铅得电子被还原,故C错误;D.电池放电时,硫酸参加反应生成水,所以溶质的质量减少,溶剂的质量增加,所以溶液酸性减弱,故D错误;
考点:二次电池的有关知识

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如下图所示,计算反应4~8 min 间的平均反应速率和推测反应16 min 时反应物的浓度,结果应是( )。
| A.2.5 μmol·L-1·min-1和2.0 μmol·L-1 |
| B.2.5 μmol·L-1·min-1和2.5 μmol·L-1 |
| C.3.0 μmol·L-1·min-1和3.0 μmol·L-1 |
| D.5.0 μmol·L-1·min-1和3.0 μmol·L-1 |
用石墨作电极电解200 mL CuSO4溶液,电解过程中电子转移的物质的量n(e-)与产生气体的体积V(g)(标准状况)的关系如图所示,下列说法正确的是 ( )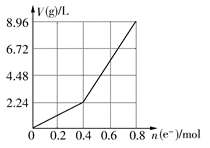
| A.电解前CuSO4溶液的物质的量浓度为2 mol/L |
| B.电解后所得溶液中c(H+)=2 mol/L |
| C.当n(e-)=0.6 mol时,V(H2):V(O2)=2:3 |
| D.向电解后的溶液中加入16 g CuO,则溶液可恢复为电解前的浓度 |
a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块如图所示放置一段时间。下列有关描述错误的是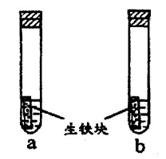
| A.生铁块中的碳是原电池的正极 |
| B.a试管内压强变大,b试管内压强变小 |
C.两试管中相同的电极反应式是:2Fe Fe2++2e- Fe2++2e- |
| D.两试管中均发生了电化腐蚀 |
以下现象与电化学腐蚀无关的是 ( )。
| A.黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| B.生铁比软铁芯(几乎是纯铁)容易生锈 |
| C.铁质器件附有铜质配件,在接触处易生铁锈 |
| D.银质奖牌久置后表面变暗 |
甲醇燃料电池被认为是21世纪电动汽车的最佳候选动力源,其工作原理如图所示。下列有关叙述正确的是 ( )。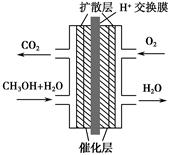
| A.通氧气的一极为负极 |
| B.H+从正极区通过交换膜移向负极区 |
| C.通甲醇的一极的电极反应式为CH3OH+H2O-6e-=CO2↑+6H+ |
| D.甲醇在正极发生反应,电子经过外电路流向负极 |
如图,缠上金属条的铁钉插在含有酚酞的NaCl溶液中,可以看到在金属条表面的溶液出现粉红色。该金属条可能是 ( )。
| A.铜 | B.镁 | C.铝 | D.锌 |
查处酒后驾驶采用的“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为CH3CH2OH-2e-=X+2H+。下列说法中正确的是 ( )
| A.电池内部H+由正极向负极移动 |
| B.另一极的电极反应式为:O2+4e-+2H2O=4OH- |
| C.乙醇在正极发生反应,电子经过外电路流向负极 |
| D.电池总反应为:2CH3CH2OH+O2=2CH3CHO+2H2O |
如图为氢氧燃料电池示意图,按此图的提示,下列叙述不正确的是( )。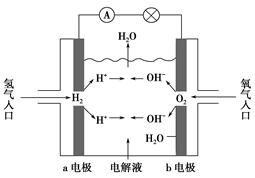
| A.a电极是负极 |
| B.b电极的电极反应为:4OH--4e-=2H2O+O2↑ |
| C.氢氧燃料电池是一种具有应用前景的绿色电源 |
| D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置 |