题目内容
查处酒后驾驶采用的“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为CH3CH2OH-2e-=X+2H+。下列说法中正确的是 ( )
| A.电池内部H+由正极向负极移动 |
| B.另一极的电极反应式为:O2+4e-+2H2O=4OH- |
| C.乙醇在正极发生反应,电子经过外电路流向负极 |
| D.电池总反应为:2CH3CH2OH+O2=2CH3CHO+2H2O |
D
解析

练习册系列答案
 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
汽车等机动车辆的启动电源常用铅蓄电池,放电时的电池反应如下:
PbO2+Pb+2H2SO4=2PbSO4+2H2O,根据此反应判断下列叙述中正确的是
| A.Pb02是电池的负极 |
| B.负极的电极反应式为:Pb+SO42--2e-=PbSO4 |
| C.PbO2得电子,被氧化 |
| D.电池放电时,溶液酸性增强 |
下列与金属腐蚀有关的说法正确的是
| A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是( )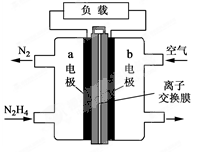
| A.b极发生氧化反应 |
| B.a极的反应式:N2H4+4OH--4e-=N2↑+4H2O |
| C.放电时,电流从a极经过负载流向b极 |
| D.其中的离子交换膜需选用阳离子交换膜 |
两电极用导线连接插入电解质溶液中(不考虑溶液中溶解的氧气的影响),你认为不能构成原电池的是( )
| 选项 | A | B | C | D |
| 电极材料 | Zn | Fe | Cu | Al |
| 电极材料 | Cu | Zn | Ag | C |
| 电解质溶液 | CuCl2 溶液 | H2SO4溶液 | CuSO4 | NaOH溶液 |
如图所示,将铁棒和石墨棒插入1 L 1 mol·L-1食盐水中。下列说法正确的是( )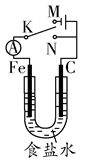
| A.若电键K与N连接,铁被保护不会腐蚀 |
| B.若电键K与N连接,正极反应式是4OH--4e-=2H2O+O2↑ |
| C.若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜 |
| D.若电键K与M连接,当两极共产生28 L(标准状况)气体时,生成了1 mol NaOH |
下列说法不正确的是 ( )
| A.粗铜电解精炼时,应将粗铜与直流电源的正极相连 |
| B.金属的吸氧腐蚀的过程中,正极的电极反应式为O2+2H2O+4e-=4OH- |
| C.燃料电池中加入燃料的电极一定是电池的负极 |
| D.在生产生活中,为保护钢铁器件免受腐蚀,应将该器件与直流电源的正极相连 |
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O电解,Al2O3+3H2↑
电解过程中,以下判断正确的是 ( )。
| | 电池 | 电解池 |
| A | H+移向Pb电极 | H+移向Pb电极 |
| B | 每消耗3 mol Pb | 生成2 mol Al2O3 |
| C | 正极:PbO2+4H++2e=Pb2++2H2O- | 阳极:3Al+3H2O-6e- =Al2O3+6H+ |
| D |  |  |
如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1 mol时,下列说法不正确的是 ( )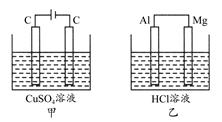
| A.溶液的质量变化:甲减小乙增大 |
| B.溶液pH变化:甲减小乙增大 |
| C.相同条件下产生气体的体积:V甲=V乙 |
| D.电极反应式:甲中阴极为Cu2++2e-=Cu,乙中负极为Mg-2e-=Mg2+ |