题目内容
如右图所示,在大试管里固定一段光亮无锈的弯成螺旋状的铁丝,把试管倒插入水中,把这个装置这样放置一周后,观察到铁丝发生的变化是_____________________,试用电极反应式和必要的化学方程式表示该过程:______________,_______________。试管里的水面会上升,最终上升高度约为_____________,原因是(用必要的文字及反应式表示)____________。
【答案】
生锈 负极:Fe-2e- Fe2+,正极:O2+2H2O+4e-
Fe2+,正极:O2+2H2O+4e- 4OH-,Fe2++2OH-====Fe(OH)2,4Fe(OH)2+O2+2H2O====4Fe(OH)3;2Fe(OH)3====Fe2O3+3H2O
4OH-,Fe2++2OH-====Fe(OH)2,4Fe(OH)2+O2+2H2O====4Fe(OH)3;2Fe(OH)3====Fe2O3+3H2O O2约占空气的
O2约占空气的 ,因在正极发生反应:O2+2H2O+4e-====4OH-,当O2消耗尽时,水上升高度约为
,因在正极发生反应:O2+2H2O+4e-====4OH-,当O2消耗尽时,水上升高度约为
【解析】
试题分析:铁丝在水中发生变化,并要求写电极反应式,则必定发生电化学腐蚀。由于是中性环境,因此只能发生吸氧腐蚀。由于O2约占空气的 ,因在正极发生反应:O2+2H2O+4e-=4OH-,当O2消耗尽时,水上升高度约为
,因在正极发生反应:O2+2H2O+4e-=4OH-,当O2消耗尽时,水上升高度约为 。
。
考点:考查钢铁的电化学腐蚀中电极反应式的书写、计算
点评:该题是基础性试题的考查,试题注重基础,主要是考查学生对教材基础知识的熟悉了解掌握程度,以及灵活运用基础知识解决实际问题的能力,也有利于培养学生的规范答题能力。

练习册系列答案
相关题目
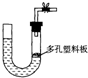
 “酒是陈的香”,就是因为酒在储存过程中生成了有香 味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.
“酒是陈的香”,就是因为酒在储存过程中生成了有香 味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.

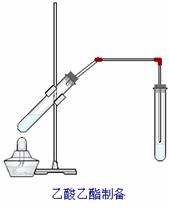 如右图所示,在大试管中先加入2 mL 95%的乙醇,并在摇动下缓缓加入3 mL浓硫酸,再加入2 mL乙酸,充分摇匀。在小试管中加入5 mL饱和Na2CO3溶液。按图连接好装置,用酒精灯对大试管小火加热3~5 min后,改用大火加热,当观察到小试管中有明显现象时停止实验。 (1)写出大试管中主要反应的化学方程式: ; (2)加入浓硫酸的作用是:___________________;
如右图所示,在大试管中先加入2 mL 95%的乙醇,并在摇动下缓缓加入3 mL浓硫酸,再加入2 mL乙酸,充分摇匀。在小试管中加入5 mL饱和Na2CO3溶液。按图连接好装置,用酒精灯对大试管小火加热3~5 min后,改用大火加热,当观察到小试管中有明显现象时停止实验。 (1)写出大试管中主要反应的化学方程式: ; (2)加入浓硫酸的作用是:___________________;