题目内容
下列实验与对应的图象符合的是( )
A、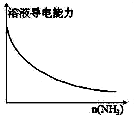 向一定量的CH3COOH溶液中通入NH3至过量 |
B、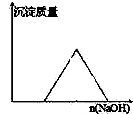 向等物质的量的HCl和AlCl3溶液中滴入NaOH溶液至过量 |
C、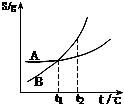 表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B饱和溶液升温至t2℃时,溶质的质量分数B=A |
D、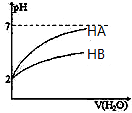 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液 |
考点:酸碱混合时的定性判断及有关ph的计算,溶解度、饱和溶液的概念,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.溶液的导电能力与溶液中的离子浓度有关,离子浓度越大,其导电能力越大;
B.向等物质的量的HCl和AlCl3溶液中滴入NaOH溶液至过量,氢氧化钠先和盐酸反应,然后和氯化铝反应生成氢氧化铝沉淀,氢氧化铝和氢氧化钠反应生成偏铝酸钠,根据各个量之间的关系式判断;
C.根据图象可知,温度升高,A、B的溶解度都增大,将t1℃时A、B饱和溶液升温至t2℃时,两溶液的溶质、溶剂都没有发生变化,所以质量分数不变;
D.弱电解质溶液中存在电离平衡,加水稀释促进弱电解质电离,稀释过程中pH变化大的酸性较强,酸性越强,对应盐的水解程度越小,溶液的pH越小,据此进行判断.
B.向等物质的量的HCl和AlCl3溶液中滴入NaOH溶液至过量,氢氧化钠先和盐酸反应,然后和氯化铝反应生成氢氧化铝沉淀,氢氧化铝和氢氧化钠反应生成偏铝酸钠,根据各个量之间的关系式判断;
C.根据图象可知,温度升高,A、B的溶解度都增大,将t1℃时A、B饱和溶液升温至t2℃时,两溶液的溶质、溶剂都没有发生变化,所以质量分数不变;
D.弱电解质溶液中存在电离平衡,加水稀释促进弱电解质电离,稀释过程中pH变化大的酸性较强,酸性越强,对应盐的水解程度越小,溶液的pH越小,据此进行判断.
解答:
解:A.醋酸是弱电解质,在溶液中离子浓度较小,向醋酸溶液中通入NH3至过量,醋酸和氨气反应生成强电解质醋酸铵,离子浓度增大,溶液的导电能力增大,图象曲线变化与实际不相符,故A错误;
B.向等物质的量的HCl和AlCl3溶液中滴入NaOH溶液至过量,发生的化学反应为:HCl+NaOH=NaCl+H2O AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O,根据反应方程式知,生成氢氧化铝沉淀需要氢氧化钠的物质的量应该为淀完全溶解消耗氢氧化钠物质的量的3倍,图象中消耗氢氧化钠的物质的量相等是错误的,故B错误;
C.升高温度,A和B的溶解度都增大,将t1℃时A、B饱和溶液升温至t2℃时,两溶液的溶质、溶剂都没有发生变化,t1℃时溶质的质量分数B=A,则t2℃时溶质的质量分数B=A,故C正确;
D.常温下,稀释HA、HB两种酸的稀溶液时,HA的pH变化较大,说明酸性:HA>HB,酸性越强,对应的盐的水解程度越小,溶液的pH越小,则同浓度的NaA溶液的pH小于NaB溶液,故D错误;
故选C.
B.向等物质的量的HCl和AlCl3溶液中滴入NaOH溶液至过量,发生的化学反应为:HCl+NaOH=NaCl+H2O AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O,根据反应方程式知,生成氢氧化铝沉淀需要氢氧化钠的物质的量应该为淀完全溶解消耗氢氧化钠物质的量的3倍,图象中消耗氢氧化钠的物质的量相等是错误的,故B错误;
C.升高温度,A和B的溶解度都增大,将t1℃时A、B饱和溶液升温至t2℃时,两溶液的溶质、溶剂都没有发生变化,t1℃时溶质的质量分数B=A,则t2℃时溶质的质量分数B=A,故C正确;
D.常温下,稀释HA、HB两种酸的稀溶液时,HA的pH变化较大,说明酸性:HA>HB,酸性越强,对应的盐的水解程度越小,溶液的pH越小,则同浓度的NaA溶液的pH小于NaB溶液,故D错误;
故选C.
点评:本题为图象分析题,涉及弱电解质的电离、溶液的导电性、盐的水解原理、饱和溶液的溶解度与温度的关系等知识,题目难度中等,明确图象中曲线的变化趋势、曲线的拐点的含义是解本题关键,试题培养了学生的分析、理解能力.

练习册系列答案
相关题目
下列与有机物的结构、性质、用途有关的叙述,不正确的是( )
| A、乙醇、乙酸、乙酸乙酯都能发生取代反应 |
| B、乙酸乙酯、油脂与NaOH溶液反应均有醇生成 |
| C、乙烯和聚乙烯中均含有不饱和碳碳双键 |
| D、淀粉和蛋白质都是高分子化合物 |
某有机物的结构为 ,下列有关说法正确的是( )
,下列有关说法正确的是( )
 ,下列有关说法正确的是( )
,下列有关说法正确的是( )| A、1mol该物质与足量浓溴水反应,最多消耗2mol Br2 |
| B、1mol该物质最多能与2mol NaOH反应 |
| C、1mol该物质最多能与3mol H2加成 |
| D、该物质的核磁共振氢谱共有6个吸收峰 |
1L 0.2mol/L的KI溶液中,含溶质KI的物质的量是( )
| A、0.2 mol |
| B、0.5 mol |
| C、2 mol |
| D、5 mol |
下列对淀粉、纤维素的叙述正确的是( )
| A、它们的组成都是(C6H10O5)n,但n值不同,因此淀粉、纤维素互为同系物 |
| B、它们都不溶于水,在热水中颗粒会膨胀破裂,发生酯化作用 |
| C、它们都属于高分子化合物,一定条件下都可以水解,最终产物都是葡萄糖 |
| D、淀粉是还原性糖,纤维素是非还原性糖 |
根据已知条件,对物质的性质强弱判断不正确的是( )
| A、已知HF的共价键键能比HCl大,说明稳定性:HF>HCl | ||||
| B、已知正反应的活化能大于逆反应的活化能,说明总能量:生成物>反应物 | ||||
C、已知 +SO2+H2O→ +SO2+H2O→ +Na2SO3,说明给出质子能力:HSO3->苯酚 +Na2SO3,说明给出质子能力:HSO3->苯酚 | ||||
D、已知CaCO3+SiO2
|
分离苯和水混合物的操作方法是( )
| A、过滤 | B、分液 | C、萃取 | D、蒸馏 |
金刚石与石墨是碳的两种同素异形体,在100kPa时,1mol石墨转化为金刚石要吸收1.895kJ的热量,下列说法正确的是( )
| A、金刚石比石墨稳定 |
| B、1mol石墨比1mol金刚石的总能量低 |
| C、1mol石墨比1mol金刚石的总能量高 |
| D、石墨比金刚石稳定 |