题目内容
3.X、Y、Z、R、W为前四周期元素且原子序数依次增大.X的单质与Y的单质在放电条件下反应产生大气污染物,R基态原子的M能层上有3对成对电子,W核外有5个未成对电子.Y、Z分别形成氢化物Q和J,已知Q与J摩尔质量相等,Q的水溶液中加入少量WY2,立即产生大量气泡.请回答下列问题:(1)X的氢化物与R的氢化物相遇,生成物中存在的化学键类型有离子键、共价键.W在元素周期表中的位置为第四周期第ⅦB族.
(2)XY3-离子的立体构型是平面三角形;ZY42-中的一个Y原子被Z替换后形成Z2Y32-,则Z2Y32-离子中心原子的杂化轨道类型为sp3杂化杂化.Z2Y32-在稀硫酸中的反应为S2O32-+2H+=S+SO2↑+H2O.
(3)已知:氢气、Z的固态单质、气态J的燃烧热分别为285.8 kJ/mol、296.8 kJ/mol、562,.0 kJ/mol,则气态J分解生成固态Z和氢气的热化学方程式为:H2S(g)═S(s)+H2(g)△H=+20.6 kJ/mol.
(4)在酸性溶液中,WY4-能被Q还原为W2+,该反应的离子方程式是2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O.
(5)第二周期中第一电离能介于Be与x元素之间的元素分别是C和O,与w同周期的最外层仅有一个未成对电子的原子分别是Cr和Cu,其中价电子数目最多的原子其电子排布图为1s22s22p63s23p63d104s1.
分析 X、Y、Z、R、W为前四周期元素且原子序数依次增大,X的单质与Y的单质在放电条件下反应产生大气污染物NO,则X是N、Y是O元素;R基态原子的M能层上有3对成对电子,则R是Cl元素;W核外有5个未成对电子,则W是Mn元素;Y、Z分别形成氢化物Q和J,Q与J摩尔质量相等,Q的水溶液中加入少量MnO2,立即产生大量气泡,则Q是H2O2、J是H2S,所以Z是S元素,据此分析解答.
解答 解:(1)X的氢化物是氨气、R的氢化物是HCl,二者相遇生成氯化铵,氯化铵中铵根离子和酸根离子之间存在离子键、N原子和H原子之间存在共价键;Mn元素在元素周期表中的位置为第四周期第ⅦB族,
故答案为:离子键、共价键;第四周期第ⅦB族;
(2)NO3-中N原子价层电子对个数是3且不含孤电子对,所以为平面三角形;SO42-中的一个O原子被S替换后形成S2O32-,硫酸根离子和硫代硫酸根离子互为等电子体,硫酸根离子中S原子价层电子对个数是4且不含孤电子对,所以硫酸根离子中S原子杂化方式为sp3杂化,则硫代硫酸根离子中S原子杂化方式为sp3杂化,S2O32-在稀硫酸中的反应为在S2O32-+2H+=S+SO2↑+H2O;
故答案为:平面三角形;sp3杂化;S2O32-+2H+=S+SO2↑+H2O;
(3)氢气、S(s)、气态H2S的燃烧热分别为285.8 kJ/mol、296.8 kJ/mol、562.0 kJ/mol,H2S分解时△H=285.8 kJ/mol+296.8 kJ/mol-562.0 kJ/mol=+20.6 kJ/mol,
所以其热化学方程式为H2S(g)═S(s)+H2(g)△H=+20.6 kJ/mol,
故答案为:H2S(g)═S(s)+H2(g)△H=+20.6 kJ/mol;
(4)在酸性溶液中,MnO4-能被H2O2还原为Mn2+,双氧水被氧化生成氧气,离子方程式为2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O,
故答案为:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O;
(5)X是N,第一电离能大于O,则第二周期中第一电离能介于Be与x元素之间的元素分别是C和O,W是Mn元素,与w同周期的最外层仅有一个未成对电子的原子分别是Cr和Cu,其中价电子数目最多的原子即Cu其电子排布图为:1s22s22p63s23p63d104s1.故答案为:C和O;Cr和Cu;1s22s22p63s23p63d104s1.
点评 本题考查位置结构性质相互关系及应用,涉及氧化还原反应、热化学方程式的书写、原子杂化、化学键等知识点,综合性较强,正确推断元素、物质是解本题关键,同时考查学生知识迁移能力,知道硫代硫酸根离子中S原子杂化方式判断,为易错点.

| A. | 由原子构成的晶体不一定是原子晶体 | |
| B. | 分子晶体中的分子间可能含有共价键 | |
| C. | 分子晶体中一定有共价键 | |
| D. | 分子晶体中分子一定紧密堆积 |
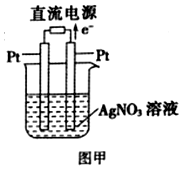
| A. | NaNO2 | B. | AgNO3 | C. | BaCO3 | D. | BaSO4 |
| A. | 溶液的浓度增大 | |
| B. | 溶液的pH增大 | |
| C. | 溶液中钠离子与碳酸根离子的物质的量之比变小 | |
| D. | 溶液的质量分数不变 |
| A. | 动物体内的葡萄糖被氧化为CO2的过程是热能转化为化学能的过程 | |
| B. | 植物的光合作用是把太阳能转化为热能的过程 | |
| C. | 化石燃料和植物燃料燃烧时放出的能量均来源于太阳能 | |
| D. | 电解饱和食盐水是把化学能转化为电能 |
 (1)常温下,0.5mol甲醇在氧气中充全燃烧生成CO2和液态水,放出热量363.3kJ.写 出甲醇燃烧的热化学方程式CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.6kJ•mol-1.
(1)常温下,0.5mol甲醇在氧气中充全燃烧生成CO2和液态水,放出热量363.3kJ.写 出甲醇燃烧的热化学方程式CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.6kJ•mol-1.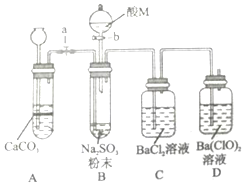 SO2是一种有毒气体,但可用于酒精的防腐剂,可以抵抗微生物的侵袭.甲同学用Na2SO4制备SO2,并验证SO2的部分性质.设计了如下实验步骤及装置:
SO2是一种有毒气体,但可用于酒精的防腐剂,可以抵抗微生物的侵袭.甲同学用Na2SO4制备SO2,并验证SO2的部分性质.设计了如下实验步骤及装置: