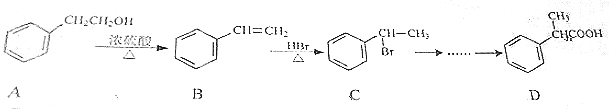
题目内容
3.如图中X是分子式为C4H2Br2O4的六元环状化合物.核磁共振氢谱表明其分子中只有一种类型的氢原子.已知:同一个碳原子上连有两个羟基时不稳定,会自动失水,即 试回答下列问题:
试回答下列问题:
(1)B中所含官能团的名称醛基.
(2)X的结构简式
 .它可以发生ab(填字母)
.它可以发生ab(填字母)a、取代反应 b、消去反应 c、加成反应
(3)写出A和C按物质的量之比为1:1混合,在一定条件下发生酯化反应生成链状酯的化学方程式.HOOC-COOH+HOCH2CH2OH$→_{△}^{浓硫酸}$HOOC-COOCH2CH2OH+H2O.
(4)D有多种同分异构体,写出同时满足以下三个条件的一种同分异构体的结构简式
 、
、 .
.①能与NaHCO3溶液反应放出气泡 ②能发生水解反应 ③分子内含有环状结构.
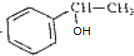
分析 X分子式为C4H2Br2O4,为六元环化合物,碱性条件下水解、再酸化得到A与B,可推知X含有酯基,B氧化得到A,B能与氢气发生加成反应生成C,则B中存在-CHO,核磁共振氢谱表明其分子中只有一种类型H原子的吸收峰,则X为 ,故A为HOOC-COOH,B为OHC-CHO,C为HOCH2CH2OH,A与B发生酯化反应反应生成环酯D,以此解答该题.
,故A为HOOC-COOH,B为OHC-CHO,C为HOCH2CH2OH,A与B发生酯化反应反应生成环酯D,以此解答该题.
解答 解:X分子式为C4H2Br2O4,为六元环化合物,碱性条件下水解、再酸化得到A与B,可推知X含有酯基,B氧化得到A,B能与氢气发生加成反应生成C,则B中存在-CHO,核磁共振氢谱表明其分子中只有一种类型H原子的吸收峰,则X为 ,故A为HOOC-COOH,B为OHC-CHO,C为HOCH2CH2OH,A与B发生酯化反应反应生成环酯D,
,故A为HOOC-COOH,B为OHC-CHO,C为HOCH2CH2OH,A与B发生酯化反应反应生成环酯D,
(1)B为OHC-CHO,含有的官能团为醛基,故答案为:醛基;
(2)X为 ,含有酯基,可发生取代反应,含有Br原子,可发生消去、取代反应,故答案为:ab;
,含有酯基,可发生取代反应,含有Br原子,可发生消去、取代反应,故答案为:ab;
(3)A为HOOC-COOH,C为HOCH2CH2OH,二者按1:1混合,发生酯化反应生成链状酯的方程式为HOOC-COOH+HOCH2CH2OH$→_{△}^{浓硫酸}$HOOC-COOCH2CH2OH+H2O,
故答案为:HOOC-COOH+HOCH2CH2OH$→_{△}^{浓硫酸}$HOOC-COOCH2CH2OH+H2O;
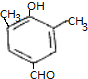
(4)D有多种同分异构体,其中满足以下条件:a、能与NaHCO3溶液反应放出气泡,含有-COOH,b、能发生水解反应,含有酯基,c、分子内含有环状结构,符合条件的任意两种同分异构体的结构简式为: 、
、 ,
,
故答案为: 、
、 ;
;
点评 本题考查有机物推断与合成、官能团结构与性质、同分异构体等,为高考常见题型,侧重于学生的分析能力的考查,根据有机物的分子式与反应条件进行推断,需要学生熟练掌握官能团的性质与转化,难度中等.

| A. | 甲一定是共价化合物,乙一定是离子化合物 | |
| B. | 甲一定是共价化合物,乙可能是共价化合物 | |
| C. | 甲可能是离子化合物,乙可能是共价化合物 | |
| D. | 甲一定是离子化合物,乙可能是共价化合物 |
| A. | 标准状况下,11.2LN0与02的混合气体含有的分子数为0.5NA | |
| B. | 常温下,1mol铁与足量的硫反应,转移电子为2NA | |
| C. | 常温常压下,22gC3H8中含有的共价键数8NA | |
| D. | 0.1mol/L的CH3COONa溶液20mL,含有CH3COO-数目为0.002NA |
(1)Ti(BH4)2是一种重要的储氢材料.在基态Ti2+中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9.
(2)CH4中共用电子对偏向C,SiH4中硅元素为+4价,则C、Si、H的电负性由大到小的顺序为C>H>Si.
(3)①甲醇(CH3OH)分子内的O-C-H键角小于(填“大于”、“等于”或“小于”)甲醛(H2C═O)分子内的O-C-H键角.
②ClO2-中心氯原子的杂化轨道类型为,写出CN-的等电子体的分子式N2(写出1个).
③石墨烯的应用为电子行业的发展带来了重大的突破,其结构可以看作是单层的石墨,其中碳原子的杂化方式为sp2;
(4)根据表中的数据回答问题
| 有机物 | 甲醇(CH3OH) | 丙烯(CH3CH=CH2) | 一氟甲烷(CH3F) |
| 相对分子质量 | 32 | 42 | 34 |
| 沸点/℃ | 64.7 | -47.4 | -78.2 |
②1mol丙烯中所含σ键和π键数目之比为8:1
③一氟甲烷的空间构型为四面体型.
| A. | Na+、OH-、Cu2+ | B. | H+、SO42-、HCO3- | C. | SO42-、Cl-、Na+ | D. | Ca2+、Cl-、CO32- |

(1)碘元素在周期表中的位置为第五周期,第ⅤⅡA族.
(2)已知:X2(g)+H2(g)=2HX(g)(X2表示C12、Br2和12).如图1表示平定
衡常数K与温度t的关系.
①△H表示X2与H2反应的焓变,△H<O.(填“>“、“<’’或‘‘=’’)
②曲线a表示的是12(填“C12”、“Br2“或“12’’)与H2反应时K与t
的关系.
II.C12是一种重要的化工原料.
(3)液氯储存区贴有的说明卡如表(部分):
| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇更物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是铁与氯气反应生成的氯化铁,对氯与苯的反应有催化作用.
③氯气含量检测仪工作原理示意图如图2:C12在Pt电极放电的电极反应式是Cl2+2e-+2Ag+═2AgCl.
(4)质量标准要求液氯含水量(以1g氯气含水的质量计)<0.4mg,含水量超标会严重腐蚀钢瓶.液氯含水量的测定装置如图3所示:(已知:P2O5+3H2O=2H3PO4;C12与P2O5不反应.)检测液氯的含水量,根据如图,需要测定的数据是分别测定通液氯样品前后a、c的质量.
 .
.