题目内容
(1)根据杂化轨道理论,下列离子或分子:NF3、NO2+中氮分别采用(2)NH3的键角
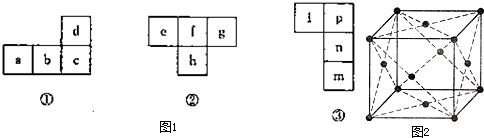
(3)冰是面心立方,下面是NaCl、I2、干冰、金刚石几种晶体的晶胞结构,其中与冰的晶体类型相同的是

(4)Ni2+在基态时,核外电子排布式为
(5)在下图的配合物中画出配位键和氢键(Ni的配位数为4)

分析:(1)根据价层电子对互斥理论确定其中心原子杂化类型;
(2)成键电子对间的距离越远,成键电子对间的排斥力越小;
(3)根据晶体的构成微粒判断晶体类型,冰是分子晶体;
(4)Ni2+核外有26个电子,根据构造原理写出其基态离子核外电子排布式;
(5)配位键由提供孤电子对的原子指向提供空轨道的离子,氧原子和羟基上的氢原子能形成氢键.
(2)成键电子对间的距离越远,成键电子对间的排斥力越小;
(3)根据晶体的构成微粒判断晶体类型,冰是分子晶体;
(4)Ni2+核外有26个电子,根据构造原理写出其基态离子核外电子排布式;
(5)配位键由提供孤电子对的原子指向提供空轨道的离子,氧原子和羟基上的氢原子能形成氢键.
解答:解:(1)NF3、NO2+中价层电子对个数分别是4、2,所以中心原子N原子分别sp3、sp采取杂化,
故答案为:sp3、sp;
(2)氟的电负性大于氢,因此用于N-F成键的电子对更偏向氟 (或离氮原子核较远),氮周围电子密度减小(或N-F成键电子对间的“距离”较远),斥力较小,因而键角较小,
故答案为:大于;氟的电负性大于氢,因此用于N-F成键的电子对更偏向氟 (或离氮原子核较远),氮周围电子密度减小(或N-F成键电子对间的“距离”较远),斥力较小,因而键角较小;
(3)冰是分子晶体,根据图片知,干冰、碘晶体的构成微粒都是分子,所以都属于分子晶体,故选BC;
(4)Ni2+核外有26个电子,根据构造原理知,其核外电子排布式为:[Ar]3d8 ,故答案为:[Ar]3d8 ;
(5)配位键由提供孤电子对的原子指向提供空轨道的离子,氧原子和羟基上的氢原子能形成氢键,所以其配位键、氢键分别为 ,
,
故答案为: .
.
故答案为:sp3、sp;
(2)氟的电负性大于氢,因此用于N-F成键的电子对更偏向氟 (或离氮原子核较远),氮周围电子密度减小(或N-F成键电子对间的“距离”较远),斥力较小,因而键角较小,
故答案为:大于;氟的电负性大于氢,因此用于N-F成键的电子对更偏向氟 (或离氮原子核较远),氮周围电子密度减小(或N-F成键电子对间的“距离”较远),斥力较小,因而键角较小;
(3)冰是分子晶体,根据图片知,干冰、碘晶体的构成微粒都是分子,所以都属于分子晶体,故选BC;
(4)Ni2+核外有26个电子,根据构造原理知,其核外电子排布式为:[Ar]3d8 ,故答案为:[Ar]3d8 ;
(5)配位键由提供孤电子对的原子指向提供空轨道的离子,氧原子和羟基上的氢原子能形成氢键,所以其配位键、氢键分别为
 ,
,故答案为:
 .
.点评:本题考查了原子杂化方式的判断、配位键及氢键的画法、键角大小的判断等知识点,这些都是学习重点,根据价层电子对互斥理论确定中心原子杂化方式即可,难点是配位键、氢键的判断,难度中等.

练习册系列答案
相关题目
根据杂化轨道理论预测下列分子或离子的空间构型(提示:含氧酸是几元酸就有几个羟基连接在成酸原子上)。
| CO2 | |
|
|
中心原子的杂化方式 |
|
|
|
|
分子的立体构型 |
|
|
|
|