题目内容
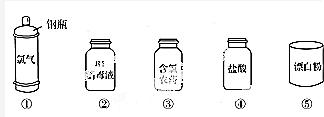
17.分别除去下列括号中的杂质,所选试剂或操作不正确的是( )| A. | SiO2(CaO):HCl | B. | MgO(Al2O3):NaOH | C. | CO2(SO2):Ca(OH)2 | D. | NaCl(NH4Cl):加热 |
分析 A.CaO与HCl反应,而SiO2不能;
B.Al2O3与NaOH反应,而MgO不能;
C.CO2、SO2均与Ca(OH)2反应;
D.NH4Cl加热生成气体,NaCl加热无变化.
解答 解:A.CaO与HCl反应,而SiO2不能,则与足量盐酸反应后过滤可除杂,故A正确;
B.Al2O3与NaOH反应,而MgO不能,则与足量NaOH溶液反应后过滤可除杂,故B正确;
C.CO2、SO2均与Ca(OH)2反应,不能除杂,应利用饱和碳酸氢钠溶液、洗气除杂,故C错误;
D.NH4Cl加热生成气体,NaCl加热无变化,则加热法可除杂,故D正确;
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
8.下列化学用语书写正确的是( )
| A. | CO2的结构式为:O-C-O | |
| B. | 作为相对原子质量测定标准的碳核素:${\;}_{6}^{14}$C | |
| C. | 氯化镁的电子式: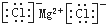 | |
| D. | 用电子式表示氯化氢分子的形成过程: |
5. 高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示.下列推断合理的是( )
高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示.下列推断合理的是( )
 高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示.下列推断合理的是( )
高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示.下列推断合理的是( )| A. | 铁是阳极,电极反应为 Fe-6e-+4H2O=FeO42-+8H+ | |
| B. | 电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极 | |
| C. | 若隔膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO42- | |
| D. | 电解时阳极区pH 降低、阴极区 pH升高,撤去隔膜混合后,与原溶液比较 pH升高(假设电解前后体积变化忽略不计) |
12.现有CuO和Fe2O3的混合物a g,向其中加入1.0mol/L的硝酸溶液200mL,恰好完全反应.若将2a g该混合物用足量CO还原,充分反应后剩余固体的质量为( )
| A. | (2a-1.6)g | B. | 2(a-1.6)g | C. | (a-1.6)g | D. | (2a-3.2)g |
2.“可燃冰”又称“天然气水合物”,它是在海底的高压、低温条件下形成的,外观像冰.1体积“可燃冰”可贮载100~200体积的天然气.下面关于“可燃冰”的叙述不正确的是( )
| A. | “可燃冰”有可能成为人类未来的重要能源 | |
| B. | “可燃冰”是一种比较洁净的能源 | |
| C. | “可燃冰”提供了水可能变成油的例证 | |
| D. | “可燃冰”的主要可燃成分是甲烷 |
9.一定条件子啊,化学反应处于平衡状态时,下列说法一定正确的是( )
| A. | 反应不再进行 | B. | 反应物浓度等于生成物浓度 | ||
| C. | 各组分浓度不再随时间而变化 | D. | 反应物的质量等于生成物的质量 |
6.下列关于化学反应速率的说法正确的是( )
| A. | 化学反应速率是指一定时间内任何一种反应物浓度的减少或者任何一种生成物浓度的增加 | |
| B. | 化学反应速率为“0.8 mol/(L•s)”表示的意思是:时间为1 s时,某物质的浓度为0.8 mol/L | |
| C. | 对于任何化学反应来说,反应速率越大,反应现象越明显 | |
| D. | 根据化学反应速率的大小可以知道化学反应进行的快慢 |