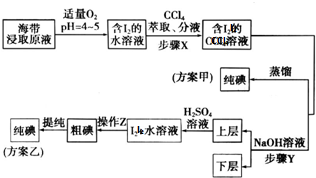
题目内容
2.亚硫酸钠溶液中加入过量的碘酸钾酸性溶液,反应的化学方程式为(未配平):Na2SO3+KIO3+H2SO4→Na2SO4+K2SO4+I2+H2O.回答下列问题:
(1)若反应中有5mole-转移,则生成碘是0.5mol.
(2)该反应过程和机理较复杂,一般认为分为以下几步:
①IO3-+SO32-→IO2-+SO42-(慢)
②IO2-+SO32-→IO-+SO42-(快)
③IO-+SO32-→I-+SO42-(快)
④5I-+6H++IO3-→3I2+3H2O(快)
⑤I2+SO32-+H2O→2I-+SO42-+2H2(快)
由上述条件推测,此反应的总的反应速率由第①步反应决定(填序号).
(3)若预先加入淀粉溶液,由题述看,必须在SO32-离子消耗完时,蓝色现象才会产生.
分析 应中S元素化合价由Na2SO3中+4价升高为+6价,总共升高2价,I元素化合价由KIO3中+5降低为I2中0价,总共降低10价,化合价最小公倍数为10,故Na2SO3系数为5,故I2系数为1,再结合原子守恒配平;
(1)I元素化合价由KIO3中+5降低为I2中0价,每生成1molI2转移10mol电子,据此计算生成碘的物质的量,再根据m=nM计算质量;
(2)由慢反应决定整个反应过程的速率;
(3)由反应④可知,SO32-的还原性大于I-,可被I2氧化,据此解答.
解答 解:反应中S元素化合价由Na2SO3中+4价升高为+6价,总共升高2价,I元素化合价由KIO3中+5降低为I2中0价,总共降低10价,化合价最小公倍数为10,故Na2SO3系数为5,故I2系数为1,再结合原子守恒配平后方程式为5Na2SO3+2KIO3+H2SO4=5Na2SO4+K2SO4+I2+H2O;
(1)I元素化合价由KIO3中+5降低为I2中0价,每生成1molI2转移10mol电子,故反应中有5mol电子转移,生成的碘的物质的量为$\frac{5mol}{10mol}$×1mol=0.5mol,故答案为:0.5;
(2)由慢反应决定整个反应过程的速率,故反应速率由①步反应决定,故答案为:①;
(3)由反应④可知,SO32-的还原性大于I-,可被I2氧化,故需消耗完SO32-,才会生成I2,才会有溶液变蓝的现象产生,
故答案为:SO32-.
点评 本题考查氧化还原反应的配平与计算等,难度中等,注意反应中电子的转移数目的计算,比较容易.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
13.下列有机物的表达式不正确的是( )
| A. | 乙烯(C2H4)的电子式: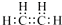 | B. | 丙烯(C3H6)的结构简式:CH2CHCH3 | ||
| C. | 立方烷(C8H8)的键线式: | D. | 溴乙烷(C2H5Br)的比例模型: |
17.下列实验误差分析错误的是( )
| A. | 用润湿的pH试纸测稀碱溶液的pH,测定值偏小 | |
| B. | 容量瓶中含有少量蒸馏水对所配制的溶液无影响 | |
| C. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| D. | 测定中和反应的中和热时,保温效果越好,测定误差越小 |
7.常温下,向0.1mol•L-1CH3COOH溶液中不断加水,过程中始终保持增大的是( )
| A. | c(H+) | B. | Ka(CH3COOH) | C. | c(H+)•c(OH-) | D. | $\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ |
14.将下列各种液体分别与溴水混合并振荡,静置后混合液分为两层,溴水层几乎无色的是( )
| A. | 苯 | B. | 酒精 | C. | 碘化钾溶液 | D. | 己烷 |
11.可逆反应H2(g)+I2(g)?2HI(g)达到平衡的标志是( )
| A. | H2、I2、HI的浓度相等 | B. | 混合气体的颜色不再改变 | ||
| C. | H2、I2、HI的浓度之比为1:1:2 | D. | 混合气体的平均相对分子质量不变 |
17.下列关于元素周期表的说法正确的是( )
| A. | 第IA族的所有元素都是金属元素 | |
| B. | 同周期主族元素中,第ⅦA族元素原子半径最小 | |
| C. | 短周期元素形成离子后,最外层都达到8电子稳定结构 | |
| D. | -般在元素周期表的金属与非金属分界线附近寻找一些化学反应新型催化剂 |
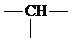 .则它的可能结构有( )
.则它的可能结构有( )